ミトコンドリアの機能異常を含む骨格筋固有の病変、新たな治療標的として注目
京都大学iPS細胞研究所(CiRA)は1月17日、脊髄性筋萎縮症(Spinal Muscular Atrophy: SMA)に関わるタンパク質(Survival Motor Neuron:SMN)が骨格筋分化過程においてMYOD-miRNA経路を制御することにより、ミトコンドリアの機能的成熟を促進することを明らかにしたと発表した。この研究は、同大CiRA臨床応用研究部門の池中亮裕研究員、齋藤潤教授らの研究グループによるもの。研究成果は、「Life Science Alliance」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
SMAは、先天性の神経筋疾患であり、SMNをコードするSMN1遺伝子の機能喪失型変異によって発症する。SMAは重症度によってI型からIV型に分類されており、最重症型のI型では乳児期に呼吸不全によって死に至ることが知られている。現在は、ゾルゲンスマをはじめとした遺伝子標的治療薬によって、患者の予後が著明に改善されている。しかし最重症型のI型に対する効果は限定的であり、引き続き治療の改善が望まれている。
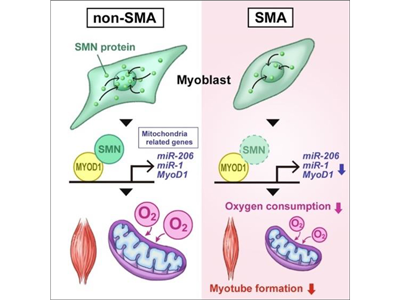
従来、SMAは運動神経疾患と考えられており、運動神経でSMNの機能が解析されてきた。一方で、近年、SMAにおいてミトコンドリアの機能異常を含む骨格筋固有の病変も報告されており、骨格筋がSMAの新たな治療標的として注目されている。しかし、SMAにおける骨格筋病変の発症機序は、明らかになっていない。そこで、研究グループは、SMA患者より樹立したiPS細胞およびマウス由来筋芽細胞を用いて、SMAにおける骨格筋病変の発症機序を調べた。
SMN欠損骨格筋細胞、ミトコンドリアの成熟に重要なmiR-1/miR-206発現量低下
まず、健常者由来iPS細胞(WT-iPS)にSMNを標的とするshRNAを導入しSMNをノックダウンしたSMN欠損WT-iPS細胞を作製した。また、SMA患者由来iPS細胞(SMA-iPS)にSMNを補充したSMN補充SMA-iPS細胞を作製した。次に、これらの細胞に対して、骨格筋分化に重要な転写因子であるMYOD1を人工的に発現させることで、骨格筋細胞へ分化誘導した。
その結果、SMN欠損WT-iPS細胞およびSMA-iPS細胞由来骨格筋細胞、つまり、SMNを欠損している2種の細胞において、分化開始の6日目にミトコンドリアの酸素消費量が低下することを確認した。さらに、SMNを持たない上記2種の細胞について、骨格筋分化の過程におけるミトコンドリアの機能制御に重要なMYOD1、miR-1およびmiR-206の発現量が低下していることがわかった。
SMNはMYOD1/miR-1/miR-206の転写調節領域に結合し転写活性制御に関与
次に、SMNの骨格筋分化過程における機能に着目して解析を進めた。ヒトiPS細胞を骨格筋細胞に分化する過程におけるSMNの発現量と細胞内での局在を調べたところ、分化開始前と比べて、分化3日目においてSMNの発現量が増加しており、SMAが細胞核内に一様に分布をすることを見出した。
この結果より、骨格筋分化過程に、SMNがゲノム上で何らかの機能を持つ可能性を考えた。MYOD1の転写は、タンパク質であるMYOD1がゲノム上の自己のMYOD1遺伝子の転写調節領域に結合することで制御されており、SMN欠損下ではMYOD1の発現量が低下することが知られている。これらのことから、SMNが転写調節領域においてMYOD1の転写制御へ関与している可能性を調べることにした。
その結果、ChIP-qPCR法により、MYOD1遺伝子の転写開始点上流においてSMNがゲノムに結合していることが明らかになった。さらに、共免疫沈降法による解析の結果、SMNとMYOD1が物理的に相互作用していることが確認された。
また、これまでにmiR-1およびmiR-206の転写についても、転写調節領域にMYOD1が結合することで、制御されていることが知られていた。そこで、miR-1およびmiR-206についても、SMNがこれらのmiRNAの転写調節領域に結合しているかをChIP-qPCR法によって調べたところ、同様にSMNの結合が認められた。これらの結果を合わせると、SMNは骨格筋分化の特定の時期に、MYOD1、miR-1およびmiR-206の転写調節領域に結合することによって、転写活性の制御に関与していることが示唆された。
SMAモデルマウス由来筋幹細胞、miR-1/miR-206導入で疾患表現型を改善
最後に、SMAにおいて発現量の低下しているmiR-1およびmiR-206を骨格筋へ導入することが、SMAの治療法として有効かを検証した。
SMAモデルマウスより単離した骨格筋幹細胞に、miR-1またはmiR-206もしくはその両方を導入後、筋管細胞へ分化誘導し、疾患表現型が改善するかを評価した。その結果、miR-1およびmiR-206の導入によって、ミトコンドリアの酸素消費量の上昇と筋管細胞の形成能の改善が認められた。
さらに、miR-1とmiR-206の導入により筋管細胞の収縮機能が改善するかを、筋管細胞の収縮加速度を解析することで検証した。その結果、miR-1とmiR-206を導入したSMAモデルマウス由来筋管細胞の収縮加速度が、野生型マウス由来筋管細胞と同程度の値まで回復した。
以上より、miR-1とmiR-206の遺伝子導入は、SMAモデルマウス由来の筋管細胞の疾患表現型を改善することが明らかになった。この結果は、miR-1とmiR-206がSMAの骨格筋を標的とした治療に有効な因子であることを示唆している。
SMAにおける骨格筋を標的とした新規治療法の開発に期待
今回の研究で、SMA患者由来の疾患特異的iPS細胞およびSMN欠損マウス筋芽細胞を用いて研究を行い、SMAにおいて、骨格筋の形成過程でmiR-1およびmiR-206の発現量が低下することで、ミトコンドリアの機能異常が引き起こされることが明らかになった。加えて、SMNがmiR-1およびmiR-206の転写開始点上流に結合していることを見出し、SMNがこれらの発現調節に関与している可能性を示した。また、SMAモデルマウスより単離した骨格筋幹細胞にmiR-1およびmiR-206を導入し筋管細胞へと分化誘導した場合、ミトコンドリアの機能、筋管細胞形成、骨格筋の収縮能が改善することがわかった。「SMAの骨格筋病変の発症機構の1つを明らかにした。今後、骨格筋を標的とした新規治療法の開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース




