体内ウイルス量ピーク後に重症化進行のCOVID-19、肺組織傷害のメカニズムは?
横浜市立大学は12月22日、新型コロナウイルス感染症(COVID-19)の重症例では、発症後早期に自己の肺組織を構成する上皮細胞の細胞死が生じ、死細胞から放出される分子が重症化の引き金となっている可能性があることを明らかにしたと発表した。この研究は、同大大学院医学研究科麻酔科学の東條健太郎講師ら、同研究科救急医学の研究グループによるもの。研究成果は、「iScience」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
COVID-19では、体内のウイルス量がピークを過ぎた後のタイミングで、病態の重症化が進行することが知られている。しかしながら、ウイルス量が減った後にどのようなメカニズムで、肺組織傷害が進行するのかはわかっていなかった。
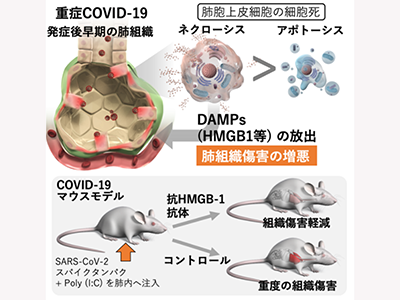
研究グループは、今までに、急性呼吸促迫症候群(Acute Respiratory Distress Syndrome:ARDS)と呼ばれる重症呼吸不全に陥ったCOVID-19症例では、発症後早期に肺組織を構成する肺胞上皮細胞の強い傷害が見られることを明らかにしていた。これを踏まえ、初期に生じた肺胞上皮細胞の傷害が、COVID-19の病態を重症化させる引き金になっている可能性があると考え、今回の研究を行った。
COVID-19によるARDS患者、血液中でHMGB-1分子濃度が増加
研究では、最初に、同大附属病院に入院した重症COVID-19症例における肺胞上皮細胞の細胞死メカニズムについて検討。細胞死は、細胞内のダメージ関連分子パターン(DAMPs)分子を放出し、炎症を引き起こす「ネクローシス」と呼ばれる細胞死と、炎症をほとんど引き起こさない「アポトーシス」と呼ばれる細胞死の2つに分類できる。
血液中および気管支肺胞洗浄液中の特異的マーカーを分析した結果、COVID-19によるARDS患者では、発症早期に主にネクローシスによって上皮細胞死が引き起こされていることが明らかになった。また、同時にCOVID-19によるARDS患者の血液中では、ネクローシス細胞から放出される代表的なDAMPsであるHMGB-1分子の濃度が増加していることが明らかになった。
COVID-19動物モデル、抗HMGB-1中和抗体投与で肺組織傷害を軽減
次に、COVID-19の原因ウイルスSARS-CoV-2の構成成分をマウスの肺の中に注入することで、COVID-19の動物モデルを作製。肺胞上皮細胞の細胞死メカニズムを詳しく解析した。その結果、COVID-19動物モデルでは、ネクロトーシスおよびパイロトーシスと呼ばれる、分子的に制御されたネクローシスが生じていることが明らかになった。さらに、このCOVID-19動物モデルに対して、抗HMGB-1中和抗体を投与することによって、肺組織傷害を軽減できることを確認した。
以上の結果から、COVID-19によるARDSでは、ウイルスそのものだけではなく、発症後早期にネクローシスに陥った肺胞上皮細胞からDAMPsが放出されることで重症化が進行することが示唆された。
DAMPsを標的とすることで病院受診後でも重症化を予防できる可能性
本研究成果によって、細胞死を引き起こした自己の細胞から放出されるDAMPsが、COVID-19の重症化を防ぐための、有効な治療標的である可能性が示された。肺胞上皮細胞の細胞死そのものは発症後早期に生じることから、予防的な介入を行うことは難しいと考えられる。しかし、その後放出されるDAMPsを標的とすることで、病院を受診した後であっても重症化を防ぐことができる可能性があり、今後の治療薬開発につながることが期待される、と研究グループは述べている。
▼関連リンク
・横浜市立大学 プレスリリース



