アントラサイクリン心筋症の5年生存率は50%以下
九州大学は11月2日、アントラサイクリン系抗がん剤による心毒性の主な原因であるフェロトーシスが誘導される分子メカニズムの全容を解明し、その治療法も発見したと発表した。この研究は、同大大学院医学研究院循環器病免疫制御学講座の池田昌隆助教、同大病院循環器内科の井手友美診療准教授、北里大学薬学部の今井浩孝教授らの研究グループによるもの。研究成果は「Science Signaling」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
アントラサイクリン系の抗がん剤(代表薬剤:ドキソルビシン)は、乳がんや卵巣がん、血液腫瘍など多くのがん種に対する標準治療として用いられる抗がん剤である。しかし、用量(総投与量)依存性に心臓機能障害(心毒性)を引き起こすことから、その総投与量は厳密に制限されている。また、厳密な制限下での使用でも約10%程度に心毒性を生じ、心毒性により発症するアントラサイクリン心筋症の5年生存率は50%以下と予後不良である。日本を含む全世界でがん罹患患者数は増加し続けており、アントラサイクリン系抗がん剤は過去10年間にその使用量は2倍に増え、今後もさらに増加することが見込まれる。このため、アントラサイクリン系抗がん剤による心毒性の仕組みを解明し、予防法を開発することは、医学的のみならず社会的にも喫緊の課題となっている。
ミトコンドリアへの鉄蓄積によるフェロトーシスが主な原因と判明、先行研究で
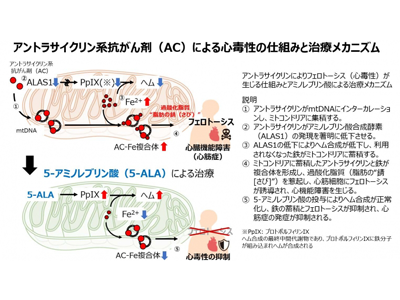
科学的見地からは、本来がん細胞の異常な増殖を標的とする抗がん剤が、ほぼ細胞増殖をしない心筋細胞に毒性を生じる仕組みは長らく不明だった。研究グループはこれまでにアントラサイクリンによりミトコンドリアに鉄が蓄積し、鉄依存性に生じる過酸化脂質に基づく細胞死・フェロトーシスがアントラサイクリン心毒性の主な原因であることを明らかにした。しかし、「なぜがん細胞や他の正常細胞よりも心筋細胞で毒性(フェロトーシス)を生じるのか」「なぜミトコンドリアに鉄が蓄積するのか」は明らかになっていなかった。
アントラサイクリン<ALAS1発現低下<ヘム合成障害<ミトコンドリアに鉄が蓄積<フェロトーシス
今回、研究グループは心筋細胞にはミトコンドリアとミトコンドリアDNA(mtDNA)が豊富に存在することとアントラサイクリンがDNAに入り込む性質に着目し、mtDNAを人為的に増減することで、アントラサイクリンのミトコンドリアへの蓄積量を解析した。これらの解析により、mtDNAの量に一致してアントラサイクリンがミトコンドリアに集積していることがわかった。一方、アントラサイクリン系抗がん剤は核DNAにも入り込み、細胞増殖を抑制することで抗がん作用を発揮するが、心筋細胞ではアントラサイクリンにより核DNAにコードされるヘム合成の律速酵素であるアミノレブリン酸合成酵素(ALAS1)の発現が大きく低下することを発見した。ヘム合成の最終段階はミトコンドリアにおいてプロトポルフィリンIXに鉄が組み込まれることで合成されるが、ヘムの合成障害により利用されなくなった鉄がミトコンドリアに蓄積していることがわかった。これらの仕組みによりミトコンドリアに蓄積したアントラサイクリンと鉄は複合体を形成し、過剰な過酸化脂質が生成されることで、フェロトーシスを誘導していることを見出した。
アミノレブリン酸、モデル動物でフェロトーシスを抑制し心筋症の発症を予防
実際に、アントラサイクリン心筋症モデル動物にALAS1が合成するアミノレブリン酸を投与することで、鉄の蓄積とフェロトーシスを抑制し、心筋症の発症を予防することに成功した。
アミノレブリン酸は生体内で合成されるアミノ酸の1種で、すでに診断薬(製品名:アラグリオ)として医薬品の承認を受けており、ヒトでの安全性も確認されている。「今後、アミノレブリン酸による心毒性の抑制薬としての開発を進めることで、さらに最適ながん治療を実現とするとともに、心臓合併症を予防することでがん患者のQOLを改善することが期待される」と、研究グループは述べている。
▼関連リンク
・九州大学 研究成果



