糖新生調節メカニズムを調べ、糖尿病の新規治療の可能性を探る
千葉大学は10月18日、肝臓内の2型自然リンパ球(ILC2)がサイトカインIL-13を強く産生することで肝細胞に作用し、糖の放出(糖新生)を抑制するメカニズムを明らかにしたと発表した。この研究は、同大医学部附属病院の藤本真徳特任助教、同大大学院医学研究院の田中知明教授(千葉大学災害治療学研究所)、同大大学院医学研究院の三木隆司教授(千葉大学災害治療学研究所)の研究グループによるもの。研究成果は、「Nature Communications」」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
世界の糖尿病人口は2030年までに6億4300万人に増加すると予測され、大きな問題となっている。糖尿病はがんや認知症合併だけでなく、新型コロナウイルス感染症の重症化リスクを引き起こすことから、「免疫代謝連関」が重要であることが想定されている。しかし、その仕組みは十分に明らかにされていない。
通常インスリンは、過剰な糖新生によって血糖値が上昇するのを抑えるが、肥満状態になると肝臓に脂質が沈着し(脂肪肝、非アルコール性脂肪性肝疾患:NAFLD)、インスリン作用が弱まり、過剰な糖新生と血糖上昇が起こる。また、災害時のストレスにより免疫機能が低下することで、糖尿病が悪化することが知られている。従って、免疫システムによる血糖調節の仕組み、特に、糖新生の調節のメカニズムを深く調べて、糖尿病の新しい治療の可能性を探る必要があった。
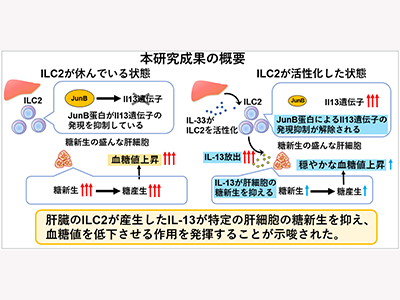
ILC2から産生されたIL-13が肝細胞からの糖新生を抑制
今回、研究グループは、一細胞解析、転写複合体解析などを駆使して研究を進め、その結果、ILC2から産生されたIL-13が肝細胞からの糖の放出(糖新生)を抑制することを示した。
同研究結果により、ILC2が肝臓の糖放出を抑制する役割が、世界に先駆けて明らかになった。肝臓は免疫細胞が豊富で代謝に重要な役割を担う臓器。研究グループは、肝臓における免疫細胞と代謝の関わりを一細胞レベルで解析することは、新たな予防や治療に結び付く可能性があると考えており、特に、免疫細胞の働きを用いた、糖尿病の治療法開発に結びつくことが期待されるとしている。
今後は、組織学的な位置情報と遺伝子発現を紐づけたまま解析できる空間的遺伝子発現解析を応用し、位置と機能の関係を解明するというさらなる分子メカニズムの解明を目指す、と研究グループは述べている。
▼関連リンク
・千葉大学 プレスリリース



