麻酔薬投与で重篤な症状を引き起こす悪性高熱症、詳細な分子メカニズムは未解明
東京慈恵会医科大学は10月7日、全身麻酔時に高体温になる悪性高熱症のモデルマウス(MHモデルマウス)の骨格筋細胞を詳細に解析し、悪性高熱症を単一細胞レベルで再現することに世界で初めて成功したと発表した。この研究は、同大基盤研究施設医学科の坪井義高氏、山澤德志子准教授、細胞生理学講座の福田紀男准教授、大阪大学蛋白質研究所の鈴木団講師の研究グループによるもの。研究成果は、「Journal of General Physiology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
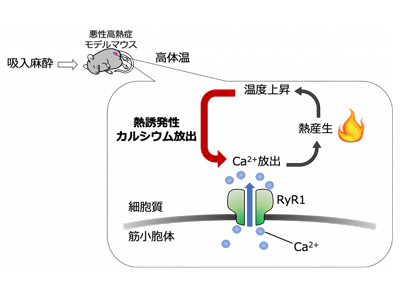
骨格筋は、細胞内のCa2+貯蔵庫である筋小胞体から骨格筋型リアノジン受容体(RyR1)を介してCa2+が放出され、Ca2+が収縮タンパク質に結合することで収縮する。しかし、RyR1に遺伝的な変異があるとCa2+が筋小胞体から過剰に放出される。悪性高熱症は、吸入麻酔や筋弛緩薬の投与を受けた後に体温の上昇、筋肉の硬直などの症状が見られる病気で、適切な処置がなされない場合、死に至ることもある。悪性高熱症の患者では、RYR1遺伝子に異常が見られることが知られている。
研究グループは、全身麻酔の手術の際に使われる吸入麻酔薬であるイソフルラン麻酔を投与することで、体温が上昇して死亡してしまう新規のMHモデルマウスを作製した。この変異マウスは、ホモ接合体では、胎児の間に子宮内で死亡してしまう。そのため、ホモ接合体細胞(ホモ細胞)のCa2+の動態については検証することができなかった。また、研究グループは最近の研究において、遺伝的な変異のあるRyR1を発現している細胞では熱刺激に敏感に応答して細胞内Ca2+濃度の上昇が引き起こされることを発見し、この現象を「熱誘発性カルシウム放出」と名付けた。しかしながら技術的な困難さのため、これまでの研究では、イソフルラン投与による動物の体温上昇と骨格筋における細胞内Ca2+濃度の上昇は別々の実験でしか確認することができず、これらの間の連動性を細胞レベルで捉えることはできなかった。そこで今回、今まで研究が進んでいなかったMHモデルマウスのホモ細胞の解析を詳細に行うとともに、細胞内Ca2+濃度の変化と細胞内温度の変化を同時に可視化することを試みた。
ホモ接合体胎児マウス、細胞内のCa2+濃度上昇により骨格筋が過剰に収縮
研究グループは、新規MHモデルマウスについて、胎児マウスの骨格筋細胞を用いて実験を行った。まず、ホモ細胞を電子顕微鏡で観察すると、サルコメアが野生型に比べて大幅に短くなっていた。次に、ホモ接合体と野生型の細胞内Ca2+濃度を測定したところ、ホモ接合体では野生型に比べて細胞内Ca2+濃度が高くなっていた。これらの結果から、死亡してしまうホモ接合体胎児マウスでは、細胞内のCa2+濃度が上昇することで骨格筋が過剰に収縮していることが強く示唆された。
さらに、骨格筋細胞に赤外線レーザーを照射し、熱刺激に対する細胞内Ca2+濃度の変化を観測した。熱刺激時、ヘテロ接合体細胞(ヘテロ細胞)において顕著な熱誘発性カルシウム放出が確認された。一方、ホモ細胞への熱刺激時には、「熱誘発性カルシウム放出」によるCa2+の放出よりも、筋小胞体にCa2+を取り込むポンプの役割を果たす筋小胞体Ca2+-ATPaseによるCa2+取り込み促進の効果の方が大きいことが観察された。これは、ホモ細胞では細胞内のCa2+濃度が高い反面、筋小胞体内のCa2+が著しく枯渇しているためであると考えられる。
麻酔投与時に細胞内温度と細胞内Ca2+濃度がどちらも上昇、単一細胞で同時測定
最後に、細胞内のCa2+の上昇が実際に温度上昇を引き起こすか否かを明らかにするために、新規に開発した蛍光温度計「ERthermAC」とCa2+に対する蛍光指示薬をMHモデルマウスのヘテロ細胞に適用し、イソフルラン麻酔投与時、細胞内温度と細胞内Ca2+濃度の変化を単一細胞において同時に測定した。そして、イソフルラン麻酔投与時に、細胞内温度と細胞内Ca2+濃度がいずれも上昇することを確認した。すなわち、イソフルラン麻酔で引き起こされる悪性高熱症を、単一細胞レベルで再現することに成功した。
「研究の結果は、悪性高熱症の分子レベルでのメカニズム解明に重要な知見を与えるとともに、予防戦略や画期的な創薬の開発を強力に促すものと期待される」と、研究グループは述べている。
▼関連リンク
・東京慈恵会医科大学 プレスリリース



