糖尿病で多いサルコペニア、筋肉特異的Akt欠損マウスを樹立し詳しい仕組みを解析
東京大学医学部附属病院は10月5日、インスリンシグナルの鍵分子Aktを筋肉のみで欠損させ、インスリン作用を低下させたマウスを樹立・解析した結果を発表した。この研究は、国立国際医療研究センター研究所糖尿病研究センターの植木浩二郎センター長(東京大学大学院医学系研究科分子糖尿病学連携教授)、東京大学の門脇孝名誉教授(現・虎ノ門病院院長)、山内敏正教授、笹子敬洋助教らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
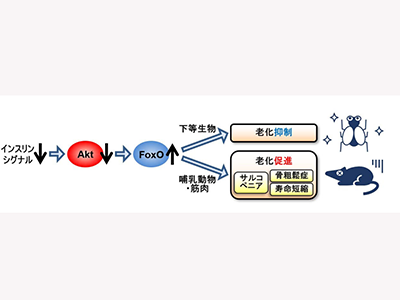
下等生物ではインスリン作用が低下すると寿命が延びるが、ヒトでのインスリン作用の低下は糖尿病につながるなど、哺乳動物におけるインスリンと老化との関連については、議論が続いている。中でも筋肉の老化現象であるサルコペニアは、糖尿病で多いことが知られているが、詳しい仕組みは明らかではなかった。
今回、研究グループは野生型マウスでの解析から、加齢マウスの筋肉ではインスリン抵抗性が、インスリンシグナルの下流の鍵分子Aktという酵素のレベルで引き起こされることを見出し、そのモデルとして筋肉のみでAktを欠損させたマウスを樹立した。
Akt欠損マウスでサルコペニアを再現、骨粗鬆症や寿命短縮も確認
研究の結果、Akt欠損マウスは、生まれてしばらくは明らかな変化を示さないが、加齢とともに全身のインスリン抵抗性と糖代謝の悪化に加え、速筋を中心とした筋量減少や筋力・持久力の低下を来たした。その原因として、速筋線維の減少、糖取り込みの低下、解糖系の低下、ミトコンドリアの減少と形態異常、活性酸素消去系低下、オートファジー不全、老化の促進などが速筋で観察された。これまでヒトのサルコペニアを再現した動物モデルはほとんど知られていなかったが、このマウスはその良いモデルになるものと考えられた。
さらに、同マウスでは骨の形成が低下し、骨の老化現象である骨粗鬆症を来たしていた。加えて生存期間を追ったところ、筋肉でのAkt欠損マウスの寿命は対照マウスよりも短縮していた。1例ずつ死因を調べたところ、対照マウスの多くは腫瘍死であったのに対し、この欠損マウスの半数は衰弱死だった。研究グループは、筋肉における1つの酵素がないだけで、全身の老化が進み、死因まで影響を受けることは興味深い現象と考えられた、としている。
痩せ型の糖尿病、極端な食事療法が老化抑制に逆効果な可能性
一般的に、カロリー制限がこのような老化を抑制するものと考えられているが、筋肉でのAkt欠損マウスにカロリー制限を行うと、生存期間は逆に更に短縮した。日本人では痩せ型の糖尿病も少なくないが、そのような場合に極端な食事療法を行なうと逆効果である可能性が考えられた。
一方で過栄養のモデルとして高脂肪食負荷を行なっても寿命は短縮しており、死因の多くは対照マウスと同様に腫瘍死だった。皮膚がん細胞を接種すると、筋肉でのAkt欠損マウスでより増大したことから、何らかの物質の分泌などを介して、筋肉が他の臓器での腫瘍増殖にも影響を及ぼすことが想定される。
Akt欠損+FoxO欠損で老化の病態が抑制、Akt欠損+mTOR活性化で寿命がさらに短縮
研究グループはさらに、Aktの下流でどの経路が重要かを明らかにするため、FoxOとmTORに着目。FoxOはAktによって活性を抑えられるため、Aktがないと活性化する。そこで筋肉でAktに加えてFoxO遺伝子を欠損させたマウスを作製。その結果、サルコペニアや骨粗鬆症などの変化がほとんど見られなかった。加えて寿命も対照マウスと同程度で、衰弱死の増加も認めなかった。薬剤の投与でも同様の効果があるとより治療につながりやすくなることから、筋肉でのAkt欠損マウスにFoxO阻害薬を4週間投与したところ、速筋重量が部分的に増加することもわかった。
一方mTORはAktによって活性化されるため、Aktがないと活性が低下する。そこで筋肉でAktが欠損し、かつmTORが活性化されるマウスを作製。その結果、解糖系の遺伝子発現や筋力は改善していたが、速筋重量は減少したままだった。持久力の改善も部分的だったが、これは活性酸素消去系が低下したまま、形態に異常のあるミトコンドリアの量だけが増えたからと考えられた。このマウスの寿命も、筋肉でのAkt欠損マウスよりさらに短縮していたという。
糖尿病でサルコペニアが多い理由、FoxO活性化が重要な可能性
今回の研究成果より、Aktの下流で、FoxOとmTORの役割は一部重なることもわかったが、糖尿病でサルコペニアが多い理由としては、FoxOの活性化が重要である可能性が示された。また、加齢に伴うインスリン作用の低下を背景としたサルコペニアの治療を考える上では、FoxOの働きを抑えることが有効な戦略となるものと考えられた。一方でmTORを活性化しても筋肉量は増えず、またミトコンドリアの量と活性酸素消去系とのバランスが崩れて、質の悪いミトコンドリアのみが増えるものと考えられた。同研究成果は、高齢化に伴って増えているサルコペニアや、日本人に多いサルコペニアを合併した糖尿病に対する治療薬の創出につながると期待される、と研究グループは述べている。
▼関連リンク
・東京大学医学部附属病院 プレスリリース



