肝線維化進行NASHでは肝組織中の脂肪沈着が減少・消失、肝硬変や肝発がんリスク高
日本医療研究開発機構は6月17日、進行NASHの一病態であるburned-out NASHについて、その病態悪化の機序をマウスモデルや臨床検体を用いて明らかにしたと発表した。この研究は、三重大学大学院医学系研究科消化器内科学の中川勇人教授、東京大学医学部附属病院消化器内科の川村聡特任臨床医、松下祐紀大学院生、小池和彦名誉教授、藤城光弘教授らの研究グループによるもの。研究成果は、「The Journal of Clinical Investigation」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
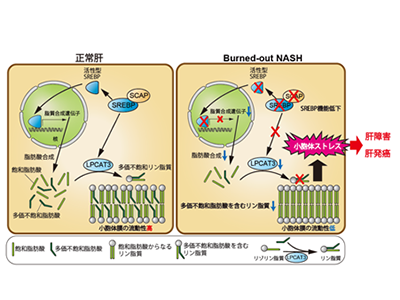
非アルコール性脂肪肝炎(nonalcoholic steatohepatitis:NASH)は、肝臓への脂肪沈着(脂肪肝)をきっかけに、炎症・線維化がおこり、肝硬変や肝がんに至る進行性の疾患だ。肝臓には糖質から脂質を合成する機能があるが、健常人では肝臓の脂質の5%程度が糖質由来であるのに対し、脂肪肝では26%に増加すると報告されている。転写因子SREBPは肝臓における脂質生合成の中心的役割を担っており、その機能亢進が脂肪肝発症の一因と考えられている。
しかし、肝線維化が進行したNASHでは、肝組織中の脂肪沈着はむしろ減少・消失し、burned-out NASHと呼ばれる状態となり、かえって肝硬変や肝発がんのリスクが高まることが知られている。しかし、burned-outという現象がNASHの病態進展においてもつ意義はほとんどわかっていなかった。
脂質生合成の低下+生体膜リン脂質の組成変化で肝細胞障害・肝がんが起こりやすくなっていた
NASHの病態を改善するには、肝脂質生合成の司令塔であるSREBPを阻害して肝脂肪蓄積量を減らせば良いと考えられる。そこで、NASH肝がんマウスモデルを用いて、SREBP活性化分子であるSCAPを肝臓で欠損させ、脂質生合成を強力に阻害した。NASHの進展・発がんを抑制できるか検討したところ、肝臓における脂肪蓄積量は減少したが、肝障害の程度はむしろ悪化し、burned-out NASHに似た肝硬変が発症し、肝発がんが著明に促進された。
burned-out NASH様病態がなぜ起こったかを解析したところ、SREBP機能低下が、生体膜の重要な構成成分であるリン脂質の分子構造に大きな変化をもたらしていたという。この変化により、小胞体の膜流動性が阻害されることで強い小胞体ストレスが生じ、結果として肝障害、肝発がんに進展することがわかった。
さらに、SREBP機能低下の影響を詳しく解析すると、脂肪酸合成低下に加えて、LPCAT3の発現低下を見出した。このLPCAT3は多価不飽和脂肪酸をホスファチジルコリンに取り込む酵素のため、リン脂質の中でもこの多価不飽和脂肪酸を含むホスファチジルコリンの低下が顕著となり、膜流動性低下につながったとわかった。
リン脂質の補充・LPCAT3発現回復で、マウス病態改善
これらメカニズムを検証するため、burned-out NASHモデルともいえる今回のマウスに、リン脂質の補充やLPCAT3の発現回復を試みた。その結果、病態の改善が見られたという。NASH患者の肝生検検体でも検討したところ、肝線維化の進行とともにSREBP経路の活性低下やLPCAT3の発現低下が生じていることがわかった。すなわち今回のマウスモデルと同様の現象が、進行したNASHの患者にも生じていることが示唆された。
進行NASHの新たな治療法につながる可能性
現在のところNASHに対して保険適用となっている薬剤はない。しかし最近、ヒトNASHにおいても病態進展とともにリン脂質組成が変化することが報告されており、今回の研究結果と合わせて、リン脂質の補充やリン脂質への脂肪酸組み込み異常の是正が、進行NASHの治療法の一つとなると期待される。また、現在NASHに対して脂質生合成経路を標的とした薬剤の開発が盛んに行われているが、今回の研究結果から、病状によっては過剰かつ広範な脂質生合成阻害はかえって病態を悪化させる可能性も示唆された。このことは、今後の薬剤開発において重要な示唆を与えると考えられる。
加えて、初期のNASHとburned-out NASHでは、病態における脂質代謝経路の働きが大きく変化しており、将来的には個々のステージに応じて、より個別化された治療戦略が必要になると考えられる、と研究グループは述べている。
▼関連リンク
・日本医療研究開発機構 プレスリリース




