BRCA1の変異によりがんが発生しやすい理由について、詳しい分子機構はわかっていなかった
名古屋大学は6月6日、ヒトの遺伝性乳がん卵巣がん症候群(hereditary breast and ovarian cancer syndrome;HBOC)に相当するBrca1(L63X/+)ラットモデルを使用した研究により、変異ラットにおいて過剰鉄を介した酸化ストレスによる発がんが促進されること、また乳がんのゲノム変化に対応した場所で染色体増幅がおこり、これはハプロ不全によりミトコンドリア傷害が起こりやすいため鉄が過剰に蓄積して、最終的にフェロトーシス抵抗性を早く獲得していることによるものであると報告した。この研究は、同大学大学院医学系研究科生体反応病理学の孔穎怡大学院生、豊國伸哉教授、量子科学技術研究開発機構の今岡達彦博士らによる共同研究グループによるもの。研究成果は、「Redox Biology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がんの原因として、喫煙や種々の化学物質など、さまざまな外因性の要因が知られているが、内因性の要因も無視することはできない。乳がんや卵巣がんの5~10%は遺伝要因が関わっており、その最も多いものがHBOCである。HBOCでは、BRCA1あるいはBRCA2というがん抑制遺伝子に、生まれつき変異(病気を起こすバリアント)が入っていることが原因であり、病気を起こすバリアントの保持者は生涯に渡り乳がんおよび卵巣がんを発症するリスクが高くなる。
BRCA1やBRCA2がん抑制遺伝子の変異は臨床的には十分に認知されているが、これらの変異によりどうしてがんが発生しやすいのか、その分子機構や促進因子は必ずしもわかっておらず、マウスを使用した遺伝子改変モデルでも、これまでヒトに対応するような結果は得られていなかった。
ラットBRCA1変異モデルで過剰鉄を介した発がんの促進
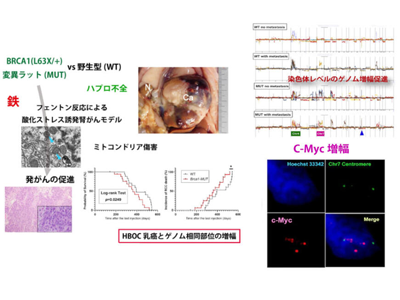
研究グループは、最近確立されたラットのBRCA1変異モデル(L63/+)の雄動物と変異のないラットを使用して、鉄ニトリロ三酢酸(Fe-NTA)投与による腎臓発がんモデル実験を行った。2年以上にわたる実験の結果、変異のあるなしで最終的な発がん率に変化はないが、変異があると有意に早く発がんがおこることがわかった。また、変異ありラットにできた腎がんでもBRCA1タンパク質の発現は残っていたことから、他のがん抑制遺伝子とは異なり、正常なBRCA1アレルが不活化されることで発がんがおこるのではなく、遺伝子が1アレルしかないためにBRCA1タンパク質の量が十分ではないことが発がんに重要であり、ハプロ不全とよばれる状態であることがわかった。
変異ラットのがんで染色体レベルのゲノム増幅
次に、研究グループは、アレイCGHとよばれる方法で、変異のあるラットと変異のないラットから発生した腎臓がんのゲノムの変化を検討した。すると、変異のないラットのがんでは染色体レベルでゲノムが失われることが多いのに対して、変異のあるラットのがんではゲノムの増幅が有意に頻度高くおこることがわかった。さらに、増幅したゲノムの位置はBRCA1/2バリアント保持者の乳がんのゲノム変化に対応した場所で起こっていた。また、がんの悪性化に関係したc-Mycがん遺伝子が共通して増幅されていることも明らかとなった。
変異ラットではミトコンドリア傷害を伴う鉄代謝異常から、フェロトーシス抵抗性が確立される
研究グループは上記の結果の発生機構を探索するため、3週までの発がんの初期に関して解析した。すると、ミトコンドリア傷害がBRCA1変異ラットで強いことが判明し、それに伴って鉄沈着の増加がおこり、それに伴う酸化ストレスに対抗する分子機構として、フェロトーシス抵抗性が確立されていることがわかった。
この研究により、BRCA1遺伝子が2アレルあることで、過剰鉄を介した酸化ストレスに伴う発がん過程において、ゲノムの増幅を抑制し、フェロトーシス抵抗性の獲得を予防していることがわかった。この成果により、BRCA1関連発がんのリスクとして、過剰鉄に伴う酸化ストレスが初めて認知された。「今後、乳腺や卵巣特異的に鉄や酸化ストレスを軽減する方法を考案できれば、リスク低減乳房・卵巣切除術が必要ではなくなり、クオリティ・オブ・ライフを改善できる可能性がある」と研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト




