2020年報告の新たな自己炎症性疾患、GTPase「CDC42」のC末端変異を有する
京都大学は5月2日、近年報告されたCDC42遺伝子のC末端突然変異による自己炎症性疾患の原因が、パイリンインフラマソームの過剰形成であることを解明したと発表した。この研究は、同大医学研究科の八角高裕准教授と伊佐(西谷)真彦博士課程学生、東北大学大学院医学系研究科の笹原洋二准教授、田口友彦教授、向井康治朗助教らの研究グループによるもの。研究成果は、「Journal of Experimental Medicine」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
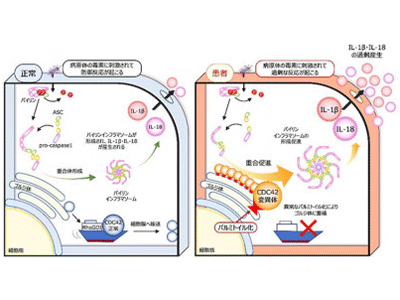
病原体を認識・排除する自己防衛システムである自然免疫に関わる機構に“インフラマソーム”がある。これは、侵入してきた細菌の毒素やペプチドに反応する細胞質センサー、アダプター分子であるASC(アポトーシス関連スペック様タンパク質)、およびタンパク質切断分子の前駆体であるpro-caspase-1からなる複合体だ。細胞質センサーにはパイリン(Pyrin)やNLRP1、NLRP3、NLRC4などがあり、各々が決まった成分に対する防御を担っている。各種センサー分子に刺激が入るとインフラマソームが重合し、caspase-1が切り出されて活性化する。活性化caspase-1は、IL(インターロイキン)-1βとIL-18を各々の前駆体から切り出したり、GasderminD(GSDMD)を切断して活性化させたりします。GSDMD断片は細胞膜に孔を開けてパイロトーシス(pyroptosis)というプログラム細胞死を誘導し、これによりIL-1βやIL-18などの炎症を惹起する物質が放出される。
自己炎症性疾患は、自然免疫の異常な反応を原因とする疾患であり、繰り返す発熱や関節炎、皮疹などの症状が認められる。代表的な疾患に家族性地中海熱(FMF)が挙げられ、この場合の原因はパイリン分子の変異だ。異常なパイリン分子は刺激に過剰反応、あるいは無刺激下で自発的に活性化してインフラマソームを形成し、発作性の発熱、腹痛や胸痛、関節炎や皮疹などを引き起こす。
近年、新しい自己炎症性疾患が次々と報告されているが、CDC42-C末端異常症というCDC42遺伝子の突然変異を原因とする疾患が2020年に報告され、研究グループもCDC42R186C変異を有する2症例を経験した。海外からの報告例と同様、出生直後より重篤な炎症を認め、ステロイドなどによる炎症抑制を行ったが救命できなかった。CDC42はGTPをGDPに加水分解する酵素であるGTPアーゼ(GTPase)の1つであり、細胞膜に局在してシグナルを伝えるスイッチの役割を果たす。しかし、CDC42分子のC末端変異が炎症を引き起こす機構は未解明だった。
CDC42<異常なパルミトイル化<ゴルジ体に異常集積
今回の研究では、患者由来のiPS細胞からマクロファージ(iPS-MP)を分化・作成し、炎症病態の評価を行った。CDC42R186C変異の患者血液中でIL-1βやIL-18が上昇していたことからインフラマソーム形成を介した自己炎症性疾患であると疑い、さまざまな刺激への反応を確認してどのインフラマソームが活性化しているかを調べた。その結果、患者由来のiPS-MPはパイリンの特異的刺激物質であるClostridium difficile毒素A(TcdA)に対して特異的に過剰反応することが判明した。
タンパク質は、遺伝子からポリペプチド鎖に変換された後にリン酸、糖鎖、脂質などが付加される“翻訳後修飾”を受ける。CDC42R186Cでは変異が起きた186番目のシステインに異常なパルミトイル化が起こり、細胞内での分布が変わることが報告されていた。またCDC42-C末端異常症の原因としてCDC42C188YとCDC42X192Cも報告されていたため併せて評価した。その結果、CDC42X192CはCDC42R186Cと同様にゴルジ体に異常集積し、CDC42C188Yは細胞膜に局在できないことがわかった。パルミトイル化阻害薬である2-ブロモパルミチン酸(2-bromopalmitate; 2-BP)によりゴルジ体への集積は解除された。
ゴルジ体に異常集積でパイリンインフラマソームが過剰形成、GTPase機能とは無関係
続いて、CRISPR-Cas9技術を用いて野生型iPS細胞にCDC42R186C、CDC42C188Y、CDC42X192Cの遺伝子変異を導入し、iPS-MPを作製して炎症の評価を行った。ゴルジ体への異常集積が確認されたCDC42C188YとCDC42X192CではIL-1βの過剰産生が起こり、2BPで改善した。一方、CDC42C188YではIL-1βの過剰産生は認められなかった。さらに、ゴルジ体に集積したCDC42分子によるパイリンインフラマソームの過剰形成は、CDC42分子のGTPアーゼとしての働きとは無関係であることも確認された。
CDC42-C末端異常症は、まれではあるものの致死的な疾患。抗IL-1β療法が奏功したという報告はあるが、今後はパイリンインフラマソームの特異的阻害剤の開発が焦点になると研究グループは予測している。また、パイリンインフラマソームは他のインフラマソームと比較して機能解析が進んでいないが、今回の結果からCDC42の局在異常が過剰活性化を引き起こすことが判明し、その活性化や制御機構を解明する重要な一歩になると研究グループは考えている。
▼関連リンク
・京都大学 最新の研究成果を知る






