孤発性AD患者の遺伝情報の特徴を明らかにし、臨床上の病態の再現を目指す
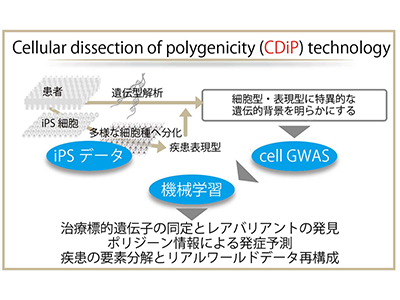
京都大学iPS細胞研究所(CiRA)は2月18日、孤発性アルツハイマー病(AD)の患者102人から樹立したiPS細胞からなるiPSコホートを用いて、102人分の大脳皮質神経細胞を作製し、複雑な孤発性ADの病態を細胞種および病態ごとの表現型(病的形質)に分解し、その背景の遺伝子データからADの臨床リアルワールドデータを再構成する「Cellular dissection of polygenicity(CDiP)テクノロジー」を開発したと発表した。この研究は、CiRA増殖分化機構研究部門の井上治久教授(理化学研究所革新知能統合研究センターiPS細胞連携医学的リスク回避チーム(上田修功チームリーダー)客員主管研究員、理研バイオリソース研究センターiPS創薬基盤開発チームチームリーダー)、CiRA増殖分化機構研究部門の近藤孝之特定拠点講師(理研革新知能統合研究センターiPS細胞連携医学的リスク回避チーム客員研究員)、理研バイオリソース研究センターiPS創薬基盤開発チームの矢田祐一郎特別研究員(研究当時)、新潟大学脳研究所遺伝子機能解析学分野の池内健教授らの共同研究グループによるもの。研究成果は、「Nature Aging」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ADは認知症を生じる神経変性疾患では最も患者が多く、2010年時点で世界に3000万人いるとされている。超高齢社会の到来とともにAD患者数は増え続け、根本的治療法がなければ、2030年には6000万人に達し、2050年には1億人を超えると推定されている。
近年の生物学的・遺伝学的研究の発展に伴い、多様な認知症、中でもADの病態に関する分子生物学的な理解が進んできたが、現時点では限られた対症療法しかない。この背景にはADの病態が複雑であり、特にAD患者の95%を占める家族歴のない孤発性ADについては、病態の遺伝的な原因を探る有効なアプローチがないことが挙げられる。そこで研究グループは、孤発性AD患者の遺伝情報の特徴を明らかにし、それを基に臨床上の病態を再現することを目的に、研究を行った。
Aβ42/40比率を表現型としてcell GWASを実施、新たに11個のAD関連遺伝子を同定
まず、孤発性AD患者102人の末梢血細胞からiPS細胞を樹立し、研究に用いる「iPSコホート」を構築。このiPSコホートを大脳皮質の神経細胞へ分化誘導した。得られた神経細胞において、ADの病態表現型の一つである老人斑の主要構成成分「アミロイドβ(Aβ)」の産生量を測定したところ、個人のAβ産生動態は一様ではなく、同じ孤発性AD患者の中でも多様な表現型があることを確認した。
次に、孤発性AD患者の病態の多様性をもたらす遺伝的背景の探索を行った。これまで、孤発性ADの遺伝的背景を調べるために、ADの発症有無や発症年齢などの臨床情報をもとにしたゲノムワイド関連解析(GWAS)が試みられてきた。この臨床情報に基づいたGWAS(clinical GWAS)から、ADとの関連が示唆される一塩基多型(SNP)や疾患感受性領域(遺伝子座)のデータが得られた。しかし、ADの病態は複雑で、生活習慣や依存症などが影響し、さらにさまざまな細胞種や病態表現型が関連して発症するため、細胞種あるいは病態表現型ごとに遺伝的背景を調べることはできなかった。ADでは細胞種ごとに異なる病態表現型が現れることから、研究グループは、病態を細胞レベルで観察しながら直接的に細胞種や病態と結び付く遺伝情報を得ることが重要であると考えた。
そこで、iPSコホートから得られたAD病態指標の一つであるAβ42/40比率を表現型として、神経細胞レベルでのGWAS(cell GWAS)を行い、Aβ42/40比率に関連する遺伝子座を探索した結果、24個の遺伝子座を同定。このうち5個の遺伝子はAβ産生に関連することが報告されており、8個の遺伝子はclinical GWASでADに関連することが示唆されていた。したがって、cell GWASは大規模な患者群を必要とするclinical GWASの結果と一部重複しており、神経細胞でのAβ42/40比率と関連する遺伝子を適切に抽出していると考えられる。また、残りの11個は新しいAD関連遺伝子として同定された。これらの遺伝子がこれまで見出せなかったのは、おそらくclinical GWASだけでは多様な交絡因子がノイズとなったためだと考えられるという。
cell GWASがADのより詳細な区分にもつながる
見出された遺伝子がどのようにAβ産生動態に影響するかを調べるために、siRNAを用いて、cell GWASで見出した24個の遺伝子を患者iPS細胞由来の大脳皮質神経細胞において、それぞれノックダウンした際のAβ42/40比率を定量した。すると、8個の遺伝子をノックダウンしたときにAβ42/40比率が変動したことから、Aβの凝集から蓄積への経路が制御可能となり、今後、これらの8遺伝子が治療の標的となる可能性が示された。
さらに、これら24個の遺伝子がADの発症に直接影響するか検証するために、日本人AD患者集団を対象としたJ-ADNI研究(アルツハイマー病の画像診断を用いたコホート研究)において取得されたデータをエクソーム解析したところ、cell GWASから見出したKCNMA1遺伝子にADのリスクとなるレアバリアントが存在することが判明。さらに、J-ADNIとは別のコホートを対象にした米国のADNI研究のエクソーム解析においても、KCNMA1遺伝子にADのリスクとなる同じレアバリアントが見出されたことから、このレアバリアントは異なる地域で普遍的であることがわかった。これらの結果から、cell GWASで得られたADの遺伝的背景の理解により、臨床上は均質なAD患者群の中から遺伝情報に基づいて特定の集団を抽出でき、ADのより詳細な区分にもつながることが示された。
cell GWASの結果が脳内Aβ沈着の有無の予測に貢献する可能性
同定されたレアバリアントにより、単独の遺伝子情報から大きなAD発症リスクを予測できるが、このレアバリアントを持つ患者の数は100人に1人以下と限定的だ。また、ADは複数の遺伝子(ポリジーン)の複合的な作用によって発症すると考えられている。
そこで、cell GWASで得られた大脳皮質神経細胞のAβ42/40比率に関連する496個のポリジーンデータセットを用い、個人のAD発症リスクの予測に取り組んだ。予測対象のデータとして、米国のADNI研究から取得した実臨床リアルワールドデータを用いた。
496人のADNI研究参加者のSNP情報を基に、それぞれの参加者のポリジーンの遺伝型を定めた。このポリジーン情報を用いた機械学習により、Aβの脳内沈着を検出するPET検査の結果を予測した。すると、年齢、性別、Aβの脳内蓄積に関わっているとされるAPOE4遺伝型の情報だけを用いたときに比べて、それらにポリジーン情報を加えるとPET検査の予測精度が向上することがわかった。この結果から、cell GWASで見出したポリジーンは、実臨床におけるAβ蓄積に関与することが示唆され、cell GWASの結果が脳内Aβ沈着の有無の予測に貢献することが示された。
CDiPテクノロジーでADなど孤発性高齢疾患の病態を解読、疾患の予知・回避の実現に期待
以上のように、iPS細胞から大脳皮質神経細胞を作製し、複雑なAD病態を細胞種および病態ごとの表現型(病的形質)に分解し、その背景の遺伝子データからADの実際の病態を再構成する新技術を「Cellular dissection of polygenicity(CDiP)テクノロジー」と命名。そして、このCDiPテクノロジーを用いることで、孤発性AD病態発症に寄与するポリジーンを同定し、個々人がAD病態を発症するかどうか予測するアルゴリズム構築、ADの遺伝子治療の標的同定といった社会実装へ向けた基盤実証を行った。
今回、主に孤発性AD患者の大脳皮質神経細胞を用いてAβに関する遺伝子情報を特定し、治療標的の同定、レアバリアントの発見、病態発症の予測を行った。しかし、脳には神経細胞だけではなく、グリア細胞であるアストロサイトやミクログリアなども存在しており、ADの複雑な病態はそれぞれの細胞種が示す多様な病的形質の総和として形成される。CDiPテクノロジーは、細胞種と病的形質の組み合わせごとにポリジーンデータおよびリスク予測情報を提供し、組み合わせ数を増やすことでAD病態をより正確に予測できると考えられる。
「今後、CDiPテクノロジーにより、ADの大脳皮質神経細胞のみならず、認知症の多種多様な病態をさまざまな細胞種で解析することにより、複雑な孤発性高齢疾患を分解・再構成し、個人の病態発症予測の社会実装が可能になると期待できる。そして、病気が生じていない無病期から個々人に必要な回避法を提案できる無病社会が期待される」と、研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース



