ステロイド治療は課題が多く、疾患メカニズム解明と新規治療法開発が求められている
東京医科歯科大学は1月10日、炎症性筋疾患において、細胞傷害性Tリンパ球からの傷害を受けて細胞死に至った筋細胞自体が、炎症や筋力低下を誘導することを突き止めたと発表した。この研究は、同大大学院医歯学総合研究科膠原病・リウマチ内科学分野の保田晋助教授、溝口史高講師、神谷麻理助教の研究グループが、岡山大学、豪州The Walter and Elisa Hall Institute of Medical Researchとの共同研究として行ったもの。研究成果は、「Nature Communications」オンライン版に掲載されている。
画像はリリースより
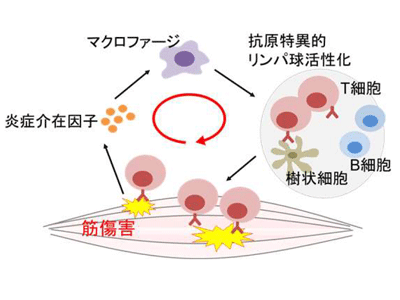
多発性筋炎などの炎症性筋疾患は、体幹や上腕、大腿などの四肢の筋力低下を主な症状とする慢性疾患。原因不明の疾患だが、その本態は自己反応性の細胞傷害性Tリンパ球(Cytotoxic T Lymphocytes、CTL)を主体とした免疫細胞が筋細胞を傷害する、自己免疫疾患であると考えられている。炎症性筋疾患の治療には副腎皮質ステロイド薬や種々の免疫抑制剤が用いられる。これらは免疫細胞を標的とした治療だが、免疫力を非特異的に抑えてしまうことから、感染症などの副作用が問題となる。また、副腎皮質ステロイド薬はステロイド筋症を誘導してさらなる筋力低下を引き起こす。さらに、これらの治療が有効でない患者や、筋の炎症が制御できた後にも筋力回復に長期間を要する患者が多数存在することも大きな課題だ。これらの多くのアンメットニーズを抱え、炎症性筋疾患の病気の成り立ちの解明と、安全かつ筋力の改善に有効な治療方法の開発が求められている。
疾患モデルマウスCIMの解析から、FASLGを介したネクロトーシスに着目
非特異的な免疫抑制を作用点とした現行の治療法が効果不十分である現状から、東京医科歯科大学膠原病・リウマチ内科の研究グループは炎症性筋疾患における筋の役割に着目した解析を行ってきた。研究グループは炎症性筋疾患のマウスモデルであるC蛋白誘導性筋炎(C protein induced-myositis、CIM)を開発し、筋細胞は、CTLからの傷害を受けた結果、細胞死に至り、種々の炎症介在因子を放出して炎症を悪化させることを突き止めた。筋細胞の細胞死がさらなる炎症を誘導する、いわば炎症の悪循環の機構が疑われることから、筋細胞の細胞死や、それに伴い炎症を増悪させる炎症介在因子の制御が炎症性筋疾患の治療に結びつくのではないかと考えられる。しかし、炎症性筋疾患における筋細胞の細胞死の機序は未解明の状況だった。
炎症性筋疾患の筋に浸潤しているCTLは、標的細胞を傷害する分子であるperforin 1(PRF1)、granzyme B(GZMB)、さらにFas ligand(FASLG)を発現している。PRF1とGZMBは協調して標的細胞を傷害するが、CIMを用いた検証ではPRF1の欠損では筋炎の抑制効果は不十分だったため、研究グループは筋傷害へのFASLGの関与を疑った。
また、過去数十年において、傷害をうけて機能不全になった細胞が至る細胞死は、遺伝子の発現によって計画的・能動的に執行されるプログラム細胞死であるアポトーシスと、細胞が受動的に融解・破裂するいわば受動的な細胞死であるネクローシスとに分類されていた。炎症性筋疾患における筋細胞にはアポトーシスの所見が乏しく、かつアポトーシス遂行経路を阻害するCFLARなどの内因性分子の発現がみられることから、筋細胞の細胞死はネクローシスと考えられてきた。しかし近年、かつてはネクローシスと考えられてきた細胞死の中にも、プログラム細胞死が含まれることが判明した。特に、CFLARなどの抗アポトーシス分子の存在下における、FASLGなどの細胞死誘導刺激が「ネクロトーシス」というプログラム細胞死を誘導すると報告されている。ネクロトーシスはRIPK1、RIPK3、MLKLなどの分子に依存し、細胞死の際にdamage-associated molecular patterns(DAMPs)やサイトカインなどの炎症介在分子の放出を伴う炎症誘導性の細胞死と知られている。
以上より研究グループは、炎症性筋疾患における筋細胞の細胞死が、FASLGを介したネクロトーシスではないかと仮説を立て、炎症性筋疾患の患者由来の筋組織や、炎症性筋疾患のマウスモデル・細胞モデルを用いて、筋細胞の細胞死の機序と、その制御が病態へ及ぼす影響を検証した。
炎症性筋疾患の筋細胞はネクロトーシスを起こし種々の炎症介在因子を放出していた
まず、炎症性筋疾患である多発性筋炎、皮膚筋炎の筋組織における細胞死関連分子の発現を免疫染色で確認したところ、傷害を受けた筋細胞は、FASLGの受容体であるFASやCFLARに加え、RIPK1、RIPK3、MLKL、リン酸化MLKLなどのネクロトーシス関連分子の高発現を認めた。一方で、筋細胞における、アポトーシスの指標であるTdT-mediated dUTP Nick End Labeling(TUNEL)染色は陰性であり、FAS/FASLGの下流でアポトーシスを誘導する活性化型CASP8の発現も認められなかった。
次に、炎症性筋疾患の細胞モデルを用いて、筋細胞のモデル細胞の筋管細胞に対して細胞死を誘導する分子を検証したところ、PRF1やGZMBではなく、FASLGが筋管細胞の細胞死誘導に必須であることがわかった。また、CTLによって傷害された筋管細胞にもアポトーシスの所見は認められず、FASやCFLARに加えてRIPK1、RIPK3、MLKL、リン酸化MLKLなどの発現が確認された。筋管細胞の細胞死はアポトーシス阻害剤で抑制されず、ネクロトーシス阻害剤であるnecrostatin-1s(Nec1s)や、筋管細胞におけるRipk3の発現阻害によって抑制された。以上より、筋管細胞の細胞死がネクロトーシスであると考えられた。さらに、CTLによる筋管細胞の傷害に伴って、細胞培養液中のインターロイキン(IL-)1、IL-6などの炎症性サイトカインや、代表的なDAMPsの一つであるHMGB1の濃度が上昇し、これらがネクロトーシスに伴い筋管細胞から放出されたものと考えられた。これらの濃度の上昇はNec1sによるネクロトーシス阻害によって抑制された。
CIMに対しネクロトーシス阻害で筋の炎症や筋力低下が改善
炎症性筋疾患のマウスモデルであるCIMの筋組織においても、炎症性筋疾患の患者の筋組織の所見と同様に、筋細胞にはアポトーシスの所見は認められず、ネクロトーシス関連分子の高発現が確認された。Ripk3やMlklを欠損したマウスに対してCIMを発症させると、これらについて野生型のマウスと比較して、筋の壊死面積が減少したのみならず、筋への炎症細胞浸潤が軽減した。さらに、CIMに対してNec1sの投与によりネクロトーシスを阻害したところ、筋の壊死面積の減少、筋の炎症の軽減に加え、筋力の改善が得られた。
ネクロトーシスに伴って放出される代表的なDAMPsの1つがHMGB1と知られるため、CIM血清中のHMGB1の濃度を測定したところ、筋炎を誘導しないマウスと比較してHMGB1の濃度の著明な上昇が確認された。血清中HMGB1濃度はNec1sによるネクロトーシス阻害治療によって低下することも示された。さらに、炎症性筋疾患の患者やCIMの筋組織において、傷害を受けた筋細胞にHMGB1の高発現が確認されたことから、細胞モデルにおける検証結果と併せて、HMGB1はネクロトーシスに至った筋細胞より放出されたと考えられた。
HMGB1抑制が炎症や筋力低下の改善に関与
HMGB1は免疫応答を増強する作用を有するため、その阻害がCIMの炎症を改善させると考え、CIMに対して抗体を用いてHMGB1を阻害したところ、対照と比較して抗HMGB1抗体を投与されたマウスでは筋の壊死面積の減少、筋の炎症の軽減に加え、筋力の改善が得られた。よって、ネクロトーシス阻害によるCIMの炎症改善効果の要因の1つが、筋細胞からのHMGB1放出の抑制であったと考えられた。また、HMGB1は非免疫的な機序により筋機能低下を誘導することも知られ、ネクロトーシス阻害による筋力改善効果にもHMGB1放出抑制が関与していたと考えられた。
炎症性筋疾患の「筋指向型」の新規治療法として期待
今回の研究によって、炎症性筋疾患において、免疫細胞からの傷害を受けた筋細胞はネクロトーシスに至り、HMGB1などの炎症介在因子の放出を介してさらなる炎症を誘導することが明らかとなった。この発見により、従来は、いわば免疫細胞の単なる標的と考えられていた筋細胞が、ネクロトーシスを介して炎症性筋疾患の病態を増悪させる攻撃者として機能することが示された。筋細胞の細胞死や、それに伴い放出される炎症介在因子を標的とした治療は、炎症性筋疾患の新しい治療戦略として期待される。研究グループは、「このような「筋指向型」の治療は、現行の炎症性筋疾患の治療法のように免疫細胞を非特異的に抑制するものではないため、感染症などの副作用が少なく、現行加療で効果不十分な症例への効果も期待できる、有望な治療法である可能性がある」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



