CRISPR/Cas9システムを用い、大脳皮質細胞でのみNPRL2・NPRL3欠損のマウス作製
東京医科歯科大学は12月22日、焦点性てんかんの新しいモデルマウスを作製し、同モデルマウスでは他の焦点性てんかんモデルと異なり、抗てんかん薬候補であるラパマイシンの効果が持続しないことを明らかにしたと発表した。この研究は、同大難治疾患研究所分子神経科学分野の石田紗恵子助教(現:東京大学医科学研究所先進動物ゲノム研究分野助教)と田中光一教授ら、東京大学医科学研究所先進動物ゲノム研究分野の真下知士教授の研究グループによるもの。研究成果は、「Human molecular genetics」オンライン版に掲載されている。
画像はリリースより
てんかんは、脳の神経細胞が異常に興奮することによって引き起こされる「発作」を特徴とし、全世界で人口の約1%が罹患するとされている。焦点性てんかんは、脳の一部の神経細胞が異常に興奮することによって引き起こされるてんかんで、異常興奮が起こる脳部位や発症の特徴によってさまざまな種類に分類される。近年、遺伝子の解析により、さまざまな種類の焦点性てんかん患者からNPRL2、NPRL3、DEPDC5変異が発見されており、これらの変異は、焦点性てんかんの最も頻繁に認められる遺伝的な原因となっている。しかし、NPRL2やNPRL3の異常が、どのようにてんかん発作を引き起こすのか不明だった。
焦点性てんかんの解明には、ヒトと同様に遺伝子変異を持ち、患者に似た症状を示すモデルマウスが役立つ。これまで、DEPDC5変異を有するてんかんモデルマウスを用いた研究は行われてきたが、NPRL2およびNPRL3に変異を持つてんかんモデルマウスは作製されていなかった。また、NPRL2やNPRL3を全身から欠損するマウスは胎児期に死亡し、焦点性てんかんの病態解明には用いることができなかった。そこで研究グループは、最新のゲノム編集技術CRISPR/Cas9システムを用い、大脳皮質の細胞でのみNPRL2およびNPRL3を欠損させたマウスを作製した。
NRPL2・NPRL3欠損マウス、自発性のてんかん発作を起こし、発作特有の脳波異常示す
研究の結果、NRPL2およびNPRL3欠損マウスは、患者と同様に、自発性のてんかん発作を起こし、発作特有の脳波異常を示した。また、患者に認められる、巨大な神経細胞の出現も再現された。
これらの結果は、NRPL2およびNPRL3欠損マウスが焦点性てんかんの病態モデルとして有用であることを示している。
NRPK2・NPRL3欠損マウス、ラパマイシン投与中止でてんかん発作再発
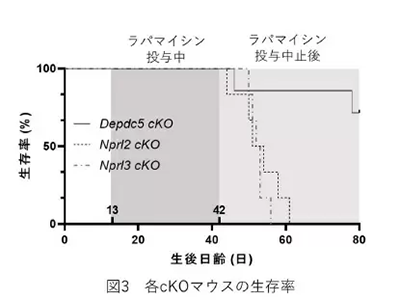
NPRL2、NPRL3、DEPDC5の変異を持つ焦点性てんかん患者では、遺伝子の転写やタンパク質の合成を担うmTORC1経路の過剰な活性化が認められる。そのため、mTORC1の抑制剤であるラパマイシンが新たな抗てんかん薬として期待されている。そこで、NRPL2およびNPRL3欠損マウスにラパマイシンを長期間投与したところ、てんかん発作の回数発が有意に抑制された。
しかし、DEPDC5欠損マウスとは異なり、NRPK2およびNPRL3欠損マウスでは、ラパマイシンの投与を中止すると効果は持続せず、てんかん発作が再発し、死亡した。
モデルマウスを利用した病態解明研究に期待
DEPDC5、NPRL2、NPRL3の遺伝子変異は、遺伝性の焦点性てんかん患者に最も多く認められる遺伝子変異だ。今回、研究グループは、NPRL2およびNPRL3遺伝子変異によるてんかんのモデルマウスを作製し、それらが患者の病態を再現することを明らかにした。今後、これらのマウスを利用した病態解明研究が進むと期待される。
また、NPRL2およびNPRL3遺伝子欠損マウスは、DEPDC5欠損マウスと異なり、新たな抗てんかん薬の候補であるラパマイシンの治療効果が持続しないことが明らかになった。これらのてんかんモデルマウスは、今後の新規治療法の開発に大きく貢献すると期待される、と研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース






