細胞外小胞は、口腔がんの放射線耐性と関わりがあるのか
熊本大学は12月13日、放射線が効きにくい口腔がん細胞が、周囲の放射線が効きやすい口腔がん細胞に放射線耐性を獲得させる仕組みを明らかにしたと発表した。この研究は、同大大学院生命科学研究部歯科口腔外科学講座の吉田遼司准教授、中山秀樹教授らの研究グループによるもの。研究成果は、「Journal of Extracellular Vesicles」に掲載されている。
画像はリリースより
放射線治療は、口腔がんに対する有効な治療法の1つだが、放射線治療が効かない、放射線耐性がん細胞の存在が臨床上の問題となっている。近年、さまざまな細胞が分泌する細胞外小胞が腫瘍細胞の治療抵抗性獲得に関与することが報告されてきたが、口腔がんの放射線耐性と細胞外小胞との関わりについてはほとんど研究されていなかった。
miR-503-3pを放射線耐性に関わる分子として同定
今回、研究グループは実際に患者が受ける放射線治療と同じように放射線照射を行って樹立した、放射線が効きにくい口腔がん細胞(以下、放射線耐性細胞)から分泌される細胞外小胞を回収し、放射線が効きやすい口腔がん細胞(以下、放射線感受性細胞)に作用させ、放射線耐性の変化を調べた。その結果、放射線耐性細胞が分泌する細胞外小胞は、放射線感受性細胞の中に取り込まれ、放射線耐性を獲得させることが明らかとなった。
また、細胞外小胞に含まれるマイクロRNAに着目し、放射線治療が奏効した口腔がん患者と、放射線治療が効きにくかった口腔がん患者の血中に存在する細胞外小胞に含まれるマイクロRNAの発現量を比較検討した。同様に、放射線感受性口腔がん細胞と放射線耐性口腔がん細胞の細胞外小胞に含まれマイクロRNAの発現量を比較検討した。その結果、放射線治療が効きにくかった口腔がん患者と、放射線耐性をもつ口腔がん細胞の両方で共通して発現が上昇しているマイクロRNA(miR-503-3p)を放射線耐性に関わるマイクロRNAとして同定した。
アポトーシスを起きにくくすることで、放射線感受性細胞に放射線耐性を獲得させる
同定したマイクロRNA(miR-503-3p)が、どのような仕組みで放射線耐性をコントロールしているかを解析した結果、細胞外小胞の中に含まれるマイクロRNAの受け渡しを介して、アポトーシス促進タンパク質であるBAKという分子の発現を抑制し、アポトーシスを起きにくくすることで、放射線感受性細胞に放射線耐性を獲得させることを明らかにした。
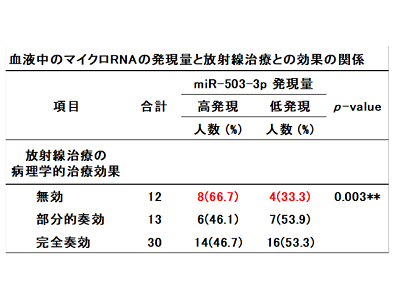
患者の血中miR-503-3p発現量が高いほど予後不良
最後に、口腔がん患者の血液中に存在するマイクロRNAを測定することで、放射線治療の治療効果や予後を予測できるかを検討したところ、口腔がん患者の血液中に存在するマイクロRNA(miR-503-3p)の発現量が高いほど治療効果が乏しくなり、予後が悪くなるということがわかった。これらのことから、血液中のマイクロRNA(miR-503-3p)を測定することで、口腔がん患者の放射線治療の治療効果や予後を予測できる可能性があることが明らかになった。
「今回の研究成果から、細胞外小胞による新たな口腔がんの放射線耐性獲得メカニズムが明らかとなった。この仕組みを応用することで、放射線治療が効きにくい口腔がんの新たな診断・治療法の開発につながる可能性がある」と、研究グループは述べている。
▼関連リンク
・熊本大学 プレスリリース



