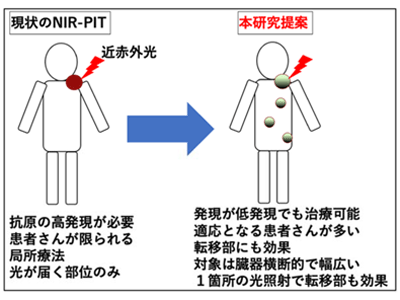
近赤外光線免疫療法は標的抗原の高発現が必要で、適応となる患者が限定的
名古屋大学は11月2日、免疫チェックポイント分子PD-L1をターゲットとし、がん免疫により効果を高めた近赤外光線免疫療法の応用開発に成功したと発表した。この研究は、同大学大学院医学系研究科呼吸器内科学の滝俊一大学院生(研究当時:博士課程4年、現:愛知県厚生農業協同組合連合会江南厚生病院呼吸器内科)、同大高等研究院・JST創発的研究支援事業採択研究者(創発1期生)・JST科学技術人材育成のコンソーシアムの構築事業次世代研究者育成プログラム対象研究者・最先端イメージング分析センター/医工連携ユニット907プロジェクトユニット長(B3ユニット:若手新分野創成研究ユニット、文部科学省研究大学強化促進事業)・同大呼吸器内科学の佐藤和秀S-YLC特任助教らの研究グループによるもの。研究成果は、「Journal for ImmunoTherapy of Cancer」(電子版)に掲載されている。
画像はリリースより
免疫チェックポイントタンパク質PD-1のリガンドであるPD-L1は、さまざまな固形がんで検出される。PD-L1は、腫瘍細胞膜に存在し、CD8(+)T細胞の免疫反応を弱め、免疫監視からの回避に働く。PD-1/PD-L1をターゲットとした免疫チェックポイント阻害薬は、現在さまざまな臓器のがんにおいて有効性が示されている。また、腫瘍のPD-L1の発現量が少なくても(TPS:Tumor Proportion Scoreが≧1%)、1次治療として利用でき、一定の効果があることが知られている。しかしながらその効果は十分ではなく、免疫チェックポイント阻害薬の効果を増強できる技術開発が求められている。
近赤外光免疫療法は、2011年に米国国立衛生研究所・国立がん研究所(NCI/NIH)の小林久隆博士らによって開発された新しいがん治療法。がん細胞が発現するタンパク質を特異的に認識する抗体と光感受性物質IR700の複合体を合成し、細胞表面の標的タンパク質に結合させた状態で690nm付近の近赤外光を照射すると、細胞が破壊される。これらの細胞死機序は、佐藤和秀S-YLC特任助教らによって、光化学反応をもとにした新概念の細胞死であることが2018年に明らかにされている。これまでと異なる方法でがん細胞を標的破壊できることから、手術・放射線・化学療法・がん免疫療法に続く「第5のがん治療」として期待されており、世界に先駆けて日本で2020年9月、EGFRを高発現する再発既治療頭頸部がんに対して、PMDAの先駆け申請制度により早期限定承認をうけて保険収載されている。
しかしながら、同承認も含め、これまでの近赤外光線免疫療法にはがん細胞に高発現する目印となるがん標的抗原が必要で、適応となる患者が限られてしまう問題点があった。幅広くこの革新的な光標的がん治療を患者に届け、一般的な標準治療として使われるようにする必要性がある。そこで今回、研究グループは、その問題点を解消し、高発現ではないが幅広くがんに低度〜中程度発現する免疫チェックポイント分子のPD-L1に注目し、がん免疫を応用した近赤外光線免疫療法の開発を企図した。そして、同治療方法は相乗的にがん免疫チェックポイント阻害剤の効果を高める効果もあることがわかった。
PD-L1を標的としたマウス実験で、腫瘍抑制と生存延長を確認
研究グループはまず、抗マウスPD-L1抗体をF(ab’)2化し(PD-L1 F(ab’)2)、PD-L1 F(ab’)2と光感受物質IR700の複合体を合成し、PD-L1 F(ab’)2-IR700を作製した。F(ab’)2化することで、PD-L1抗体の非特異的な結合がなくなり、全身性の副作用の減少が期待でき、また、IgGよりサイズが小さく腫瘍浸透性が高いと予想された。
このPD-L1 F(ab’)2-IR700を用い、マウス同種腫瘍細胞(肺がん、大腸がん、前立腺がん、メラノーマ)に対する近赤外光線免疫療法を検討。ヒトに現在認可されているEGFRの腫瘍での発現に比べるとPD-L1の発現は100分の1以下と低発現だった。この治療は、がんの細胞膜表面のがん抗原の発現量に効果が依存することがわかっている。細胞実験ではPD-L1を標的とした近赤外光線療法の効果は、EGFR高発現の腫瘍を対象とした場合にくらべて限定的であり、細胞を破壊するにはより強力な光エネルギーが必要だった。光エネルギーを十分に与えれば、細胞実験でも近赤外光線免疫療法による細胞破砕効果が見られた。以上から、細胞実験ではPD-L1を標的とした近赤外光線療法の効果は限定的で、治療応用に適していないと考えられた。
しかしながら、マウス同種移植腫瘍モデルでPD-L1 F(ab’)2-IR700を用いて単回の近赤外光線免疫療法の効果を検討したところ、細胞実験の効果からは予想できなかった、有意で多大な腫瘍の増大抑制と生存の延長が示された。さらに、マウス同種移植腫瘍の転移モデルで1か所の腫瘍に対してのみ近赤外光線を照射したところ、照射した腫瘍のみならず、近赤外光線を照射しなかった腫瘍においても腫瘍の増大抑制が得られ、生存期間が有意に延長した。
細胞実験ではわからなかった、がん微小環境の変化が効果の鍵だった
研究グループは、この細胞実験とマウス腫瘍での治療効果の矛盾を解明するために、抗腫瘍免疫の解析を引き続き実施。その結果、抗腫瘍免疫のキープレーヤーである、CD8(+)T細胞やNK細胞が腫瘍内部で活性化していることが確認された。また腫瘍微小環境を詳細に解析したところ、骨髄由来免疫抑制細胞(MDSC)が減少していることを見出した。近赤外光線免疫療法による部分的な腫瘍壊死と、PD-L1 F(ab’)2の免疫チェックポイント効果、MDSCをがん微小環境から除去する微小環境改変効果が相乗的に作用し、抗腫瘍免疫を活性化し顕著な抗腫瘍効果を及ぼすことが明らかとなった。また、マウスの血液を解析したところ、全身性に抗腫瘍免疫が増強していることが示唆された。この全身での抗腫瘍免疫活性化が近赤外光線免疫療法を行っていない、光照射をしていない腫瘍にも効果を及ぼしたと考えられた(アブスコパル効果)。
特異抗原の高発現がない患者への代替療法になると期待
今回の研究により、PD-L1を標的とする近赤外光線免疫療法は限定的な発現でも十分な抗腫瘍効果を発揮することが明らかとなった。またPD-L1を標的とした近赤外光線免疫療法は、近赤外光線照射部位のみならず、転移腫瘍にも抗腫瘍効果があることが示された。この結果は、従来の高発現の標的分子を対象とした近赤外光線免疫療法とは概念の異なる、がん免疫を応用した近赤外光線免疫療法と考えられ、適切な特異的がん抗原が高発現していない患者でも近赤外光線免疫療法の適応となりうることを示している。研究グループは、がん患者に同治療技術の適応を広げることが可能と考えており、PD-L1抗体はすでに臨床認可されていることから同治療方法は臨床応用が容易と考えている。
今回開発された治療法は、がん特異抗原の高発現を応用した近赤外光線免疫療法の適応が受けられない患者への代替治療としての近赤外光線免疫療法の提案として臨床現場で将来的に使用できると期待されるもの。今回の研究は、PD-L1を標的とした近赤外光線免疫療法をヒトの悪性腫瘍へ実装する際に、基礎的知見として貢献すると考えられる。
▼関連リンク
・名古屋大学 プレスリリース






