RTKのうちALK/LTK受容体がリガンドとどう結合し相互作用するかは不明だった
国立がん研究センターは10月14日、細胞の増殖に重要な役割を果たすALK受容体に、リガンドが結合する際の様子を、3次元結晶構造解析により初めて解明したと発表した。この研究は、国立がん研究センター研究所がんRNA研究ユニットの吉見昭秀独立ユニット長、ベルギーのゲント大学VIB-UGent Center for Inflammation Research構造生物学ユニットのDr. Savvas Savvides氏らを中心とした国際共同研究グループによるもの。研究成果は、「Nature」に掲載されている。
画像はリリースより
細胞はその表面にある受容体を介して外界とコミュニケーションをとる。その受容体に対応したリガンドがこれらの受容体に結合すると、細胞の内部に信号を伝えることができる。その信号は、細胞を増やす指示やタンパク質の産生を促す指示などさまざまだ。しかし、その受容体やリガンドの結合に何らかの異常が起こると、伝わる信号にも異常を来たす。例えば、細胞を増やす信号が過剰になってできてしまうのが、がんだと考えられている。
健康に重要な役割を果たしている受容体のグループの1つに、受容体チロシンキナーゼ(RTK)がある。このRTKは20のファミリーに分類され、約60種類の受容体が存在する。がんなどのさまざまな疾患においてRTKが重要な役割を果たしていることから、これまでにRTKについての多くの研究が進められてきた。しかし、RTKグループの1つであるALK受容体およびLTK受容体については、30年以上前から知られていたものの、受容体がリガンドとどのように結合し相互作用するかは不明なままだった。
ALK/LTK受容体の細胞外の2つの構成部分が絡みあって大きな構造体を形成
ALK/LTK受容体の細胞外構成要素として、EGF-likeドメイン、TNF-likeドメイン、Glycine-richドメインという3つのパーツが共通して存在することが知られていたが、それぞれの構造は明らかにされていない。
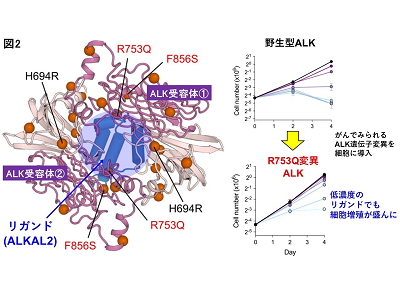
研究グループがALK受容体およびLTK受容体の構造を3次元結晶構造解析したところ、細胞外に出ている部分のうち、TNF-likeドメインとGlycine-richドメインの詳細な形状が判明し、それぞれのパーツは別々に存在するのではなく、双方が絡み合って存在し、大きな構造体を形成していることがわかった。
2個の受容体が1個のリガンドを抱きかかえるように結合することも解明
次に、リガンドが受容体と結合した際にとる立体構造について解析を行った。すると、2分子のALK受容体が1分子のリガンド(ALKAL2)を抱きかかえるように結合することが解明された。さらに、この結合には3か所の結合面が重要であることもわかった。1個のリガンドが2か所の結合面で2個の受容体と結合し、その結果として受容体同士に引き合う力が働き、3か所目の結合面が形成される。実際に受容体とリガンドあるいは受容体同士が引き合う力を弱めるような人工的な変異を加えると、細胞の増殖が抑えられることが明らかとなった。一方で、白血病などにみられるALK遺伝子の変異では、この結合面の部位の構造が変化することが予想され、遺伝子変異の結果、ALK受容体とリガンドの結合しやすさ(親和性)を増すことが示唆された。
ALK受容体に関わるがんの新しい治療法開発につながることに期待
今回の研究成果により、ALK受容体とリガンド、あるいはALK受容体同士のそれぞれの接触面における結合が、細胞のシグナル伝達・細胞増殖に重要であることが明らかになった。「今回得られた知見から、ALK/LTK受容体の構造理解がさらに深まり、また、詳細な構造解析から明らかとなった構成要素を標的にすることで、ALK/LTK受容体に関わるがんやその他の疾患に対する新しい治療法開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・国立がん研究センター プレスリリース






