IKBKAP遺伝子変異によるスプライス異常が原因、有効な治療法はまだない
京都大学は7月28日、RECTASと呼ばれる低分子化合物が家族性自律神経失調症(familial dysautonomia:FD)で見られるスプライシング異常を是正する機構を示し、iPS細胞やマウス等の疾患モデルの解析からその治療効果を示したと発表した。この研究は、同大大学院医学研究科の萩原正敏教授、網代将彦特定助教らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
FDは遺伝性感覚・自律神経系ニューロパチーIII型(HSAN III型)としても知られ、自律神経・感覚神経の発達異常、変性、衰退により流涙の欠損、口腔運動失調、消化器の運動障害、進行性の筋委縮等の、種々の感覚障害・自律神経機能障害が生じる疾患。FDの原因遺伝子は第9番染色体におけるIKBKAP(inhibitor of kappa light polypeptide gene enhancer in B-cells, kinase complex-associated protein)遺伝子で、その第4イントロン6塩基目のチミン(T)からシトシン(C)への点変異(IVS20+6T>C変異)をホモ接合型で有することが99.5%以上の症例で原因となっている。同変異はアシュケナージ系ユダヤ人種ではヘテロ保因者率が約30人に1人と特に高く、FDは疫学的にも同人種に限局した分布を示す。
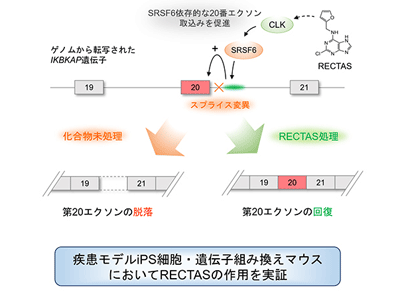
IVS20+6T>C変異が存在するとIKBKAP遺伝子の第20番エクソンのスプライス制御因子(U1snRNP)による認識が弱くなり、同エクソンの読み飛ばしが生じる。これにより、遺伝暗号翻訳の際に塩基配列の読み枠のずれが生じ、停止コドンが導入されることでIKBKAP遺伝子の正常な発現が阻害される。その結果、IKBKAP遺伝子がコードするタンパク質(ELP1、またはIKAP)の発現が低下し、その機能低下によりトランスファーRNAの機能やタンパク質合成時の正確性が低下するなど細胞機能の異常が生じることが疾患原因と考えられている。このように疾患原因の理解が近年進むものの、その一方でFDに対する有効な治療法は開発に至っていない。
SRSF6の結合がIKBKAP遺伝子の正常なスプライシング制御に必須
研究グループは、FDの原因となるスプライシング異常を抑制することが新たな治療法に結び付くと考え、IKBKAP遺伝子第20エクソンの制御メカニズムの解析と、そのスプライシング異常を抑制する低分子化合物の解析を進めた。遺伝子変異周辺の配列情報をもとに関連制御因子の解析を行ったところ、スプライシング制御にかかわるRNA結合タンパク質であるserine/arginine-rich splicing factor6(SRSF6)が、IVS20+6T>C変異の周辺RNA領域に直接結合すると判明。そして分子生物学的解析からSRSF6の結合がIKBKAP遺伝子の正常なスプライシング制御に必須であることが発見された。
低分子化合物RECTASがSRSF6依存的にスプライシング異常を是正
このSRSF6依存的な第20エクソンの取込みを促進する活性が低分子化合物RECTASにより認められた。RECTASによるスプライシング制御活性はSRSF6に依存しており、SRSF6の発現・機能を抑制した条件ではRECTASの活性に大幅な低下が認められた。また、RECTASはSRSF6の活性化に働くリン酸化酵素、CDC様キナーゼ(CLK)と結合し活性化制御を受けることが示唆された。
FD患者由来iPS細胞やマウスで治療効果を確認
さらに、FD患者細胞から樹立したiPS細胞を末梢神経細胞に分化誘導し、FDで症状が現れる末梢神経細胞においてRECTASが治療効果を示すことを確認。そしてヒト変異型IKBKAP配列を導入した遺伝子組み換えマウスを用いた薬効解析を行い、RECTASの経口投与によりマウス感覚神経細胞においてIKBKAP遺伝子のスプライシング異常が抑制されることを突き止めた。
今回の研究を通して、従来は対症療法しかなかったFDに対して、その根本原因であるIKBKAP遺伝子のスプライス異常を標的とした低分子治療薬の開発可能性が示された。FDの疾患原因であるスプライス変異と同様なメカニズムで生じるスプライシング異常は他の遺伝病においても数多く知られている。「そのような遺伝病における遺伝子変異の共通性に着目した疾患横断的な治療法探索は、今後の新しい創薬概念となる可能性がある」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る






