健康なキューティクルの形成、PAD3によるS100A3のシトルリン化が重要
茨城大学は5月14日、髪のツヤやハリを左右するキューティクルの形成に関わる重要な酵素PAD3の詳しい構造や性質を解明したと発表した。この研究は、同大大学院理工学研究科(工学野)の海野昌喜教授、量子線科学専攻博士前期課程2年の澤田瑞季氏、舟橋一真修了生らの研究グループによるもの。研究成果は、「Archives of Biochemistry and Biophysics」に掲載されている。
画像はリリースより
毛髪は、体を保護するための重要な器官の1つで、多層構造をしている1本の毛髪の最外層となるキューティクルは、S100A3タンパク質を豊富に有している。このタンパク質に含まれている、DNAにコードされていない「シトルリン」という特殊なアミノ酸は、S100A3タンパク質の中に元々備わっていたアルギニンというアミノ酸が、PAD3という酵素によって変換されたものだ。S100A3のシトルリン化がうまくできないと、健康なキューティクルが形成できない。また、老化とともに毛髪の中のシトルリン化したS100A3の量が少なくなっていくというような先行研究もある。「くしでとかせない毛髪症候群(UHS)」という、髪の毛がハリガネのようになってしまう病気は、PAD3の遺伝子変異に起因していることも知られている。
毛髪の角化と関連するPAD3の構造は不明のままだった
タンパク質中のアルギニンをシトルリンに変換する化学反応を促進する酵素は、哺乳類において5つ存在しており、それぞれPAD1~PAD4、PAD6と名付けられている。このうち、毛髪にはPAD1〜PAD3の3つが存在しているが、PAD3は他の類似酵素(PAD1やPAD2)と異なり、S100A3タンパク質に4つあるアルギニンのうちの1つを選択的にシトルリン化する。PAD3によってシトルリン化されたS100A3は、構造と性質が大きく変化することが知られており、それが毛髪の角化と関連する。
これまで、海野教授のグループは、PAD1の構造を解明したほか、先行研究で、PAD2、PAD4の構造が明らかになっていた。PAD1〜PAD4の酵素活性を抑えるような薬(阻害剤)の開発は盛んに行われている。しかし、毛髪の中でS100A3に対して特異的に働く特別なPAD3の構造はわかっておらず、この特別な反応も謎のままだった。PAD3の詳しい構造がわかれば、PAD1、PAD2、PAD4との違いをもとに、選択性が高い、すなわちピンポイントで効く、副作用の少ない薬の開発につながることから、PAD3の立体構造情報が望まれてきた。
PAD3、毛髪には存在しない類似酵素PAD4と似た立体構造
研究グループはまず、ヒト由来のPAD3の遺伝子を大腸菌に入れて、目的タンパク質であるヒトPAD3をたくさん取得することに成功した。PAD3の性質を利用したさまざまな操作によりPAD3を精製し、純度を上げ、単結晶を得た。PAD酵素はカルシウムによって活性化されることがわかっているため、カルシウム存在下・非存在下などでいくつかの状態のPAD3の結晶を得たほか、PAD3の活性が無くなる変異を入れた変異体の結晶においても同様にカルシウムの有無の状態を作成した。
これらの結晶を、放射光施設(兵庫県にあるSPring-8、つくば市にあるフォトンファクトリー)を使ったX線結晶構造解析を行い、活性型・不活性型など6つの状態のPAD3の立体構造を高分解能で明らかにした。また、類似酵素であるPAD4とS100A3タンパク質を試験管内で反応させ、二次元電気泳動で分離し、ウエスタンブロッティングでタンパク質中のシトルリンを検出。さらに、プロテアーゼとHPLCを用いて、シトルリン化したS100A3のアルギニンがどれかを確定した。その結果、PAD3の構造や性質が、毛髪に存在するPAD1やPAD2よりもむしろ、毛髪には存在しない類似酵素であるPAD4とよく似ていることを示した。
カルシウム結合がスイッチになりPAD3の活性化
カルシウムを結合するとPAD3は構造変化を起こし、活性に関わるアミノ酸の配置が完成することを示した。また、PAD3の構造中にカルシウムが結合する部位は5か所あり、5つのカルシウムイオンが順々に結合していくと考えられ、最後にカルシウムが結合する部位についても明らかになった。その最後の1つが結合しないと活性型にならないこともわかった。このことから、研究グループは、カルシウムによってスイッチが入るPAD3の活性化機構を提唱した。
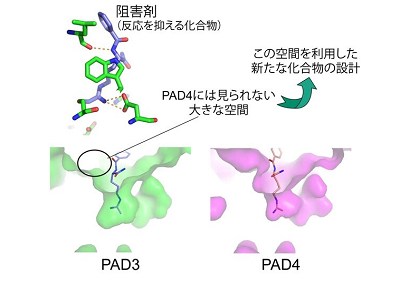
また、PAD3の反応を抑える化合物(阻害剤)が結合している構造や不活性な状態の構造も確認し、類似酵素との違いを詳細に明らかにした。その化合物を結合する部位にはPAD3のみに見られる構造的特徴(空間)があり、この空間をうまく利用することで、PAD3選択的な薬剤を作ることができる可能性があるという。
ちなみに、PAD4は、関節リウマチの原因酵素の1つであるが、今回のPAD3の構造解析の成果は、類似するPAD4の反応を抑えるようなPAD4選択的な化合物を設計する上でも有用な情報になるという。
PAD酵素が関連した病気の治療薬などへの応用に期待
今回の手法や成果は、相互に似た酵素を区別できるような化合物の設計・創製に役立ち、それぞれのPAD酵素が関連した病気の治療薬などに応用できる。また、毛髪が角化する機構やキューティクルが形成する機構を解明することに貢献するとともに、新しい美容製品・育毛剤などの開発を推進し、高齢化社会でも美しさと若々しさを保つQOL(生活の質)の向上も期待される。
一方、現在はPAD3とS100A3タンパク質がどのようにお互いを認識して反応が進行するのかがわかっていない。研究グループは、それを明らかにする1つの手段として、PAD3とS100A3が結合しているところを直接目で観察することを目指すとしている。
▼関連リンク
・茨城大学 プレスリリース






