子宮内栄養膜細胞の発生過程の研究は、技術的・倫理的に困難だった
京都大学iPS細胞研究所(CiRA)は4月8日、ナイーブ型のヒトiPS細胞を用いて、胎盤細胞の出発点にあたる栄養外胚葉(TE)を作製することに初めて成功したと発表した。この研究は、CiRA未来生命科学開拓部門の伊尾紳吾大学院生(京都大学大学院医学研究科婦人科学産科学)、同部門の蒲田未央特定職員、同部門の斎藤通紀教授(京都大学高等研究院ASHBi)、同部門の山本拓也准教授(同ASHBi)、万代昌紀教授(同婦人科学産科学)、同部門の髙島康弘講師らの研究グループによるもの。研究成果は、「Cell Stem Cell」にオンライン掲載されている。
画像はリリースより
胎盤は胎児に酸素や栄養を届ける役割を持つため、妊娠を維持する上でとても重要な臓器。胎盤の主な機能を担う栄養膜細胞の分化過程に異常が起こると、妊娠高血圧症候群や胎児発育不全などの胎盤に関連した合併症が引き起こされると考えられている。よって、子宮内の栄養膜細胞の発生過程(特に、受精卵着床後の数週間)を調べることはとても重要だが、技術点な面でも、倫理的な面でも、実際に調べることは難しい状況だった。
従来モデルでは実際の発生を再現できているとは言い切れない
これまで、マウスの栄養膜細胞の発生についての研究は行われていたが、発現する遺伝子などで、ヒトの栄養膜細胞の発生とは異なる点が多くあった。一方、ヒトの栄養膜細胞の研究は絨毛がんの細胞を使ったものがあったが、この細胞は正常細胞とは異なる性質を持つがん細胞であるため、正常状態の発生モデルに置き換えることは難しいという問題があった。2018年には、いくつかの研究グループが妊娠5~9週目のヒトの胎盤または胚盤胞を元に、体外で2次元または3次元の栄養膜細胞オルガノイドを作製することに成功しているが、実際に体内の栄養膜細胞の発生を再現できているのかは確かめられていなかった。
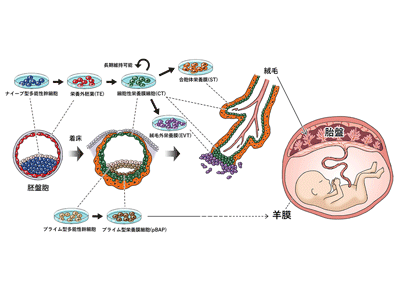
もう1つの手法として、ヒトの多能性幹細胞(iPS細胞/ES細胞)を用いる方法がある。プライム型の多能性幹細胞を用いた研究では、体内の栄養膜細胞と比べると、複数のタンパク質が異なることがわかった。ナイーブ型iPS細胞は、現行のプライム型iPS細胞と比較すると、より多くの細胞に分化できる能力を持つことが報告されている。最近では、ナイーブ型iPS細胞を使った研究が確立されてきており、プライム型よりも子宮着床前の受精卵に類似した性質を持つとされて注目されている。しかし、これまでのところ、ナイーブ型iPS細胞を用いて栄養膜細胞の発生の出発点であるTEを作製したという報告はなく、栄養膜細胞の発生モデルは確立されていなかった。そこで今回、研究グループは、ナイーブ型iPS細胞を用いて、胎盤への分化に着目し、研究を実施した。
ナイーブ型iPS細胞→TE→CT→オルガノイド作製に成功
これまでの研究で、多能性幹細胞にBMP4を加えることで栄養膜細胞への分化誘導が出来ることがわかっていた。今回の研究では、ヒトの受精卵が発現しているタンパク質を調べ、ヒトの栄養外胚葉へ分化誘導するには、A83-01、PD0325901、JAK inhibitor Iという3つの因子も重要であることを突き止め、これら4因子を混ぜた培養液を用いた。スクリーニングによって4因子の調整を行い、最適化したタイミングと比率で培養を行うと、培養3日目には約60%の割合で、多角形で平面的な形をした細胞が作製出来た。蛍光免疫染色を行い、TEのマーカーとなるタンパク質が発現していること、OCT3/4などの多能性因子が発現していないことを確かめた。さらに、RNA-seq解析によって細胞の遺伝子発現を調べたところ、上位25の遺伝子がTE特有のものであることがわかった。よって、ナイーブ型iPS細胞からTEへ分化誘導ができたと結論づけられた。
通常、ヒトの体内においては、胚盤胞のTEは着床直後に細胞性栄養膜細胞(CT)へと分化する。胎盤の蛍光免疫染色により、分裂増殖が盛んなCTの性質を調べ、A83-01、CHIR99021、EGFの3因子がCTへの分化と維持に重要であることが確認された。胎盤由来栄養膜幹細胞を維持する培地はこれまでに報告されているが、今回、さらに安定した状態を保つことができる培地が開発された。この最適化された培地は、ナイーブ型iPS細胞由来、胎盤由来の細胞性栄養膜細胞の両者に応用することが出来るという。
さらに、これまでに報告された胎盤から栄養膜細胞オルガノイドを作製する手法で、CTから3次元のオルガノイドを培養。このオルガノイドは2か月間保つことが可能で、胎盤から作った栄養膜細胞オルガノイドと極めて似た構造を持つことが観察できた。蛍光免疫染色を行うと、CTのマーカーであるITGA6が表面上で発現していることを示し、栄養膜オルガイドの表面はCTで構成されていることがわかった。今回作製したCTは自己複製能が高く、遺伝子発現や形態もヒトの胎盤から作った栄養膜細胞オルガノイドと似ていることから、栄養膜幹細胞のような細胞とみなせるという。
ST・EVT分化にも成功、栄養膜細胞の起源~最終段階を模倣する体外モデルを確立
CTは、ヒトの体内では合胞体栄養膜細胞(ST)と絨毛外栄養膜細胞(EVT)の両方へ分化できる細胞。これまでに報告されたSTとEVTへ分化誘導させる培地を用いて、今回作製したCTがSTとEVTに分化できるかを確かめた。ST誘導培地で培養した細胞を電子顕微鏡で観察すると、体内のものと同様、微絨毛(極小の突起)が多数あり、蛍光免疫染色によってSTのマーカーとなるタンパク質が発現していることが確認された。また、EVT誘導培地で培養した細胞を観察すると、体内のものと同様、紡錘形をしていることが見られた。さらに、EVTのマーカーであるHLA-Gの発現も蛍光免疫染色によって確認された。以上より、ナイーブ型のヒトiPS細胞からTEへ、TEからCTへ、CTから栄養膜細胞の最終形態であるSTとEVTへと分化させることに成功し、栄養膜細胞の起源から最終段階までを模倣する試験管内モデルが確立された。
CTとpBAPは別物、CTの方が実際の栄養膜細胞に近い
最後に、今回のモデルで作製したナイーブ型iPS細胞由来のCTを、プライム型iPS細胞から作った栄養膜様細胞(pBAP)、胎齢15日目のサルの胚、妊娠5週目で生検したヒトの絨毛膜絨毛(絨毛膜の面)と比較した。これまでの研究で、プライム型多能性幹細胞はBMP4などのタンパク質の入った培地で培養すると、栄養膜「のような」細胞が作製できることが報告されている。そこで同様の方法でプライム型iPS細胞からpBAPを作製し、ナイーブ型iPS細胞から作製したCTと比べた。結果、両者とも、KRT7やGATA3などの栄養膜細胞のマーカーが発現していることは確認できたが、HLAクラスIと19番染色体上のマイクロRNAなどの発現の有無に違いがあり、CTはpBAPよりもヒトの胎盤から作製した栄養膜幹細胞と同等の発現状態を示していることがわかった。
さらに、体内の着床直後における栄養膜細胞と比較するため、倫理的承認を得たカニクイザルの胎齢15日目の胚と、妊娠5週目で生検したヒトの絨毛膜絨毛、CTとpBAPの蛍光免疫染色を行った。すると、HSD3Bなどの栄養膜細胞に特徴的な遺伝子が、pBAP以外では発現しているのに対し、pBAPでは発現していなかった。以上より、CTとpBAPは別物であり、CTの方が実際の栄養膜細胞に近いことが明らかになった。また、CTとpBAPについて、栄養膜細胞ではなく、カニクイザルとヒトの羊膜細胞とで遺伝子発現を比べたところ、pBAPの方が羊膜に特徴的な遺伝子が多く発現していた。さらに、RT-qPCやフローサイトメトリー解析でも、pBAPはCTよりも羊膜に近い性質を示した。
従来の倫理的規制を遵守したまま初期胚研究へ
今回の研究によって、体外でヒトのナイーブ型iPS細胞を用いて、これまで達成されなかった着床前からの胎盤細胞への分化過程を模倣するモデルを構築することが出来た。これは、栄養膜細胞の着床期発生を体外で再現できたことを意味する。
ヒトの初期胚の研究は、サンプルの少なさや14日ルールなどの倫理的な規制から進めることが難しい分野だった。iPS細胞を含む多能性幹細胞は大量作製が可能なため、サンプル数を増やせ、遺伝子編集など、さまざまな実験が実施できる。今回の研究で構築されたモデルは、従来の倫理的規制を遵守したまま、初期胚の研究の可能性を広げ、将来、不妊症や、胎盤に関連した妊娠合併症の病態解明につながることが期待できる。
現在、プライム型iPS細胞から体細胞へ分化させる方法は数多く存在するが、発生ステージが異なるナイーブ型iPS細胞の分化シグナルは不明な点が多くある。今回の研究結果は、ナイーブ型iPS細胞がプライム型とは異なる分化シグナルを持つことを示唆する。今後、ナイーブ型iPS細胞を用いて、胎盤以外の細胞へ分化させる研究が発展することも期待される。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース






