マイクロRNA-33欠損マウスで肥満、褐色脂肪細胞との関連は?
京都大学は2月17日、脳内のマイクロRNA-33(miR-33)が、適応熱産生に重要であることを見出したと発表した。この研究は、同大大学院医学研究科の堀江貴裕助教、尾野亘准教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
脂肪細胞には、いわゆる皮下脂肪や内臓脂肪などの白色脂肪細胞と、主に首、肩、鎖骨や肩甲骨、腎臓周辺に存在する褐色脂肪細胞の2種類がある。この2つの脂肪細胞は、同じ脂肪であるにもかかわらず対照的で、細胞内に栄養を脂肪として貯蓄する白色脂肪細胞に対し、褐色脂肪細胞は脂肪を分解し、熱を産生することで体温の調節をする。この褐色脂肪細胞の機能低下や数の減少が、生活習慣病やメタボリックシンドロームの原因になることがわかってきた。また、特に寒い環境下では、交感神経の活動が高まるにつれて褐色脂肪細胞が活性化し、体温が下がりすぎないよう熱を産生(適応熱産生)する。
これまで研究グループは、コレステロール合成および取り込みに重要なSterol regulatory element-binding protein 2(SREBP-2)遺伝子のイントロン16にあるmiR-33の機能を、世界に先駆けて詳細に検討してきた。その結果、miR-33の存在により、低HDL-C、動脈硬化症、動脈瘤、(心臓)線維化が生じることを明らかとしてきた。一方、miR-33の欠損マウスでは肥満が生じることがわかっていたが、その原因ははっきりとしていなかった。
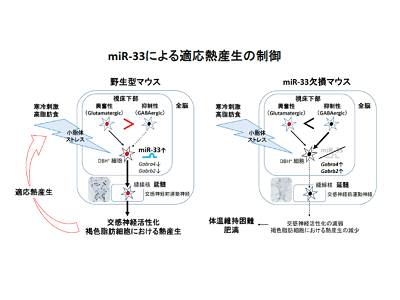
miR-33は交感神経活性の程度を増強させるスイッチとして働き、熱産生を増加
今回、研究グループは、miR-33欠損マウスが低温で体温が維持できないこと、その原因が褐色細胞からの熱産生が起きにくいことであることを明らかにした。また、カテコラミン産生細胞(交感神経)特異的にmiR-33が欠損したマウスを作製し、このマウスが全身のmiR-33欠損マウスと同様の表現型を示すことも明らかにした。この原因として、カテコラミン産生細胞がmiR-33欠損マウスの褐色脂肪細胞機能の低下が考えられた。
続いて研究グループは、miR-33が欠損していると標的遺伝子であるGABAA受容体のサブタイプ(Gabrb2とGabra4)の発現増加により抑制性のGABA神経シグナルが増強し、交感神経活性を抑制することがそのメカニズムであることを、カテコラミン産生細胞(交感神経)特異的なGabrb2とGabra4のノックダウン実験で証明した。
寒冷刺激により視床下部のmiR-33が増加することから、miR-33は視床下部において交感神経活性の程度を増強させるスイッチとして働き、熱産生を増加(適応熱産生)させていると考えられた。また、同様の機序は高脂肪食負荷でも起こり、熱産生を介して全身の代謝を調節していると推察された。
メタボリックシンドロームなど生活習慣病の予防と治療への応用に期待
今回の研究で、褐色脂肪細胞の持つ熱産生機能の生理学的メカニズムのひとつが解明された。褐色脂肪細胞の活性化はエネルギー消費を促すことから、メタボリックシンドロームの治療や、肥満改善のターゲットとして今後ますます注目されると考えられる。「中枢神経系でmiR-33の量をコントロールすることで、メタボリックシンドロームをはじめとしたさまざまな生活習慣病の予防と治療につながると期待される」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



