新型コロナウイルスのヒト細胞侵入過程、糖鎖の役割とは?
理化学研究所は2月18日、ウイルスがヒト細胞に侵入する際に起こるスパイクタンパク質の構造変化において、スパイクタンパク質表面を修飾している糖鎖が重要な役割を果たしていることを発見したと発表した。この研究は、同研究所計算科学研究センター粒子系生物物理研究チームの杉田有治チームリーダー、小林千草技師、開拓研究本部杉田理論分子科学研究室の森貴治専任研究員、ジョン・ジェウン専任技師らの研究グループによるもの。研究成果は、科学雑誌「Biophysical Journal」オンライン版に掲載されている。
画像はリリースより
2019年に発生した新型コロナウイルス(SARS-CoV-2)は、新型コロナウイルス感染症(COVID-19)として「パンデミック」とを引き起こし、2021年2月現在でも感染拡大が収束しないことから、感染予防および治療に対する有効な医薬品の早期開発が望まれている。医薬品の効率的な開発には、ウイルス感染の詳細なメカニズムを知る必要があり、感染に関与するタンパク質に対してさまざまな解析が世界的に進められている。
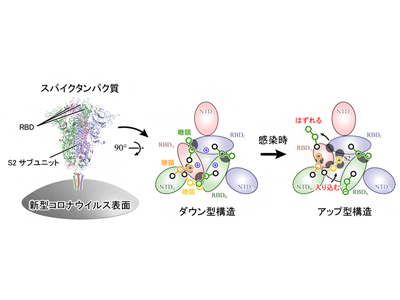
新型コロナウイルスがヒト細胞に侵入する初期段階では、ウイルスの表面に存在するタンパク質(スパイクタンパク質)がヒト細胞表面のアンジオテンシン変換酵素II(ACE2受容体)に結合して吸着し、ウイルスが侵入することで感染に至る。スパイクタンパク質は3本のポリペプチド鎖から構成され、各ポリペプチド鎖はN端ドメイン(NTD)、受容体結合ドメイン(RBD)、S2ドメインから構成される。生化学実験により、スパイクタンパク質表面の多くのアミノ酸が、糖鎖によって修飾されていることもわかってきた。スパイクタンパク質に限らず、多くのタンパク質の表面は翻訳後修飾によって糖鎖が付加されており、タンパク質が互いを認識する際にその糖鎖が用いられていると考えられている。また、ウイルスの場合は、抗体による攻撃から逃れるためにスパイクタンパク質が糖鎖で覆われているとも言われている。
X線結晶構造解析やクライオ電子顕微鏡を用いた単粒子解析により、新型コロナウイルスのスパイクタンパク質は「ダウン型」および「アップ型」の構造をとることがわかってきた。アップ型構造では、RBDがS2サブユニットから離れるように移動。スパイクタンパク質がACE2受容体に結合していないときは、ダウン型とアップ型を行き来しており(平衡状態)、ACE2受容体に結合するとアップ型がより安定になることもわかってきた。
このような構造解析実験によって、スパイクタンパク質の立体構造に対する理解が大きく進んできた一方で、揺らぎの大きい糖鎖については詳細な分子構造がわかっていない。実際、新型コロナウイルスがヒト細胞に侵入する過程において、糖鎖がどのような役割を果たしているのかは明らかでなかった。
「富岳」と「Oakforest-PACS」で分子動力学シミュレーションを実施
今回、研究グループは、スパイクタンパク質の詳細な分子構造を調べるために、スーパーコンピュータ「富岳」と「Oakforest-PACS」を用いて、ダウン型構造とアップ型構造に対する分子動力学シミュレーションを実施。分子動力学シミュレーションとは、コンピュータの中に仮想的に分子システムを構築し、原子1個1個に対してニュートンの運動方程式F=maを解くことで、安定な分子構造を理論的に予測したり、分子の動きを可視化したりする方法だ。分子システムが巨大な場合、演算量が膨大となるため、スーパーコンピュータを用いた高速な計算が必要となる。
研究グループは、2015年に分子動力学計算ソフトウェアGENESISを独自に開発。GENESISは「富岳」コデザイン開発のターゲットアプリの一つに選ばれ、ジョン・ジェウン専任技師および小林千草技師らが中心となって「富岳」に最適化し、「京」の100倍以上のアプリケーション実行性能を達成した。今回は、GENESISを用いて、スパイクタンパク質の1マイクロ秒(100万分の1秒)の分子動力学計算を行い、RBDの構造変化前後におけるアミノ酸-アミノ酸および糖鎖-アミノ酸間相互作用を網羅的に解析した。
アップ型への構造変化、RBD間の静電的な反発が駆動力となって生じることなどを示唆
解析の結果、スパイクタンパク質の165番目と234番目、343番目の3つのアスパラギンN165、N234、N343を修飾する各糖鎖が、RBDの構造安定化に重要な役割を果たしていることを発見。ダウン型ではN343とN165の糖鎖がRBDを上から覆うようにそれぞれRBD-RBD間とRBD-NTD間をつないでいる。
アップ型に変化する際は、N343の糖鎖が外れ、次いでN234の糖鎖がアップ型に変化した際に生じるRBD-S2ドメイン間の空洞に入り込み、上部に移動したRBDを下から補強するようにS2ドメインやRBDと強い水素結合を形成することが判明した。
続いて、ダウン型構造に対して静電ポテンシャルを解析。その結果、3つのRBDの境界面は378番目のリシン(K378)や407番目のアルギニン(R407)などによって広い範囲にわたり、正に帯電していることがわかったという。
これらの結果から、アップ型への構造変化は、RBD間の静電的な反発が駆動力となって起こること、さらにダウン型構造を安定化する糖鎖が外れ、RBDが移動した後に別の糖鎖が入り込むことが示唆された。今回の研究により、研究グループは新型コロナウイルス感染における詳細な分子メカニズムを解明し、糖鎖によるタンパク質の動的構造の安定化という新しい生物学的知見を得ることに成功した。
突如現れる変異種などに対しても、スーパーコンピュータを用いた対応で貢献
パンデミックを早期に収束させるためには、感染予防および治療のための医薬品開発が急務だ。スパイクタンパク質とACE2受容体との結合を阻害する中和抗体医薬品の開発では、ウイルスに結合した不完全な抗体を介した「抗体依存性感染増強」のリスクもあり、抗体や薬剤の分子設計戦略において、「ダウン型を安定化させる」あるいは「アップ型への変化を阻害する」といった、スパイクタンパク質の構造変化を考慮した多様な設計が有用と考えられる。
今回の研究成果により、スパイクタンパク質の構造変化で補強役となる糖鎖に着目し、例えば「ダウン型のRBD-RBD間の糖鎖を外さないようにする」、あるいは「アップ型になる際に入り込む糖鎖を妨害する」といった新たな戦略の創出が期待されるという。
ウイルスには変異しやすい性質、すなわち、一部のアミノ酸が別のアミノ酸に置き換わり、これまでとは異なる感染力を獲得しやすいという特徴がある。2020年12月にイギリスで発見された変異種には17か所の変異があり、感染力が従来よりも高く、さらなる社会問題となっている。
これまでに世界各国でスパイクタンパク質に対する分子動力学シミュレーションが行われ、「富岳」を用いた本研究のトラジェクトリーデータもウェブサイトで公開されている。シミュレーションで得られたタンパク質の詳細な構造情報は医薬品開発のためのヒントとなるという。「富岳」や「Oakforest-PACS」を利用することで高速な解析が可能であるため、突如現れる変異種などの問題に対しても、スーパーコンピュータを用いて迅速に対応することで、計算科学技術が社会に大きく貢献すると期待できる、と研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース






