副作用が少ない抗精神病薬の開発に役立てるため、関連する受容体の構造解析を研究
日本医療研究開発機構(AMED)は12月23日、ドパミンD2受容体の立体構造を、X線自由電子レーザー(XFEL)を用いて解明したと発表した。この研究は、京都大学大学院医学研究科の林到炫(イム・ドヒョン)助教、岩田想教授(兼理化学研究所グループディレクター)、島村達郎特定講師らの研究グループと、東北大学大学院薬学研究科の井上飛鳥准教授、同多元物質科学研究所の南後恵理子教授(兼理化学研究所客員研究員)、高輝度光科学研究センターXFEL利用研究推進室の登野健介グループリーダーらとの共同研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
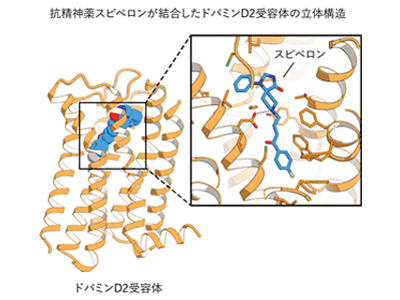
画像はリリースより
現在、統合失調症の治療薬として主に使用されているのは、非定型抗精神病薬だ。これらの薬は、脳に存在するドパミンD2受容体とセロトニン2A受容体という2種類のタンパク質の働きを抑制する(不活性化する)ことで効果を発揮している。しかし、ドパミンD2受容体やセロトニン2A受容体と類似するセロトニン2C受容体やヒスタミンH1受容体など、他のアミン受容体にも結合して不活性化することで起こる、口の渇き、眠気、体重増加、高血糖、起立性低血圧などの副作用が存在する。
近年の創薬分野では、標的タンパク質の立体構造を基にした創薬戦略(Structure-based drug design)が進められている。研究グループは、副作用が少ない抗精神病薬の開発に役立てるため、関連する受容体の構造解析研究を進めており、2019年にセロトニン2A受容体の構造を発表した。今回の研究ではさらに、ドパミンD2受容体の立体構造の解明を試みた。
ドパミンD2受容体に薬が結合するポケットは、大きく異なる2つの形をとり得ることが判明
研究では、抗精神病薬であるスピペロンが結合したドパミンD2受容体の不活性型構造を、X線結晶構造解析の手法を用いて決定した。そのためにはドパミンD2受容体の結晶を取得する必要があったが、独自に設計した安定性の高い水溶性タンパク質をドパミンD2受容体の不安定な部分と置換すること、および構造を固定する抗体フラグメントを結合させることで結晶を取得することに成功したという。また、小さな結晶から良好なデータを取得するためには、新世代のX線であるXFELの使用が必須だったため、XFELを利用したデータ測定は、日本のXFEL施設であるSACLAで実施された。
解析の結果、ドパミンD2受容体の全体構造やスピペロンが結合しているポケットは、他のアミン受容体と良く似た構造をとっていた。このことは、抗精神病薬が他のアミン受容体にも結合し、副作用を生じる原因の一つであると考えられるという。一方で、同研究で決定したドパミンD2受容体の不活性型構造は、過去に報告されていたドパミンD2受容体の不活性型構造と比べ、ポケットの入り口付近が大きく異なっていた。この結果は、ドパミンD2受容体は、大きく異なる複数の不活性型を持つことを示唆している。これまでさまざまな種類の受容体の立体構造が発表されてきたが、不活性型構造がここまで大きく変化していた例は報告されていないという。同研究ではさらに、アミン受容体ファミリーで構造が類似しているポケットの隣に、ドパミンD2受容体に特有の空洞が存在することが明らかになった。また、セロトニン2A受容体でもアミノ酸の向きを変えることで、類似の空洞を形成し得ることが示唆された。これらの結果は、変異体実験の結果からも支持されたという。
解明されたドパミンD2受容体の構造情報は、パーキンソン病治療薬の合理的な探索・設計にも役立つ可能性
今回の研究により、これまでに発表されていたものとは大きく異なるドパミンD2受容体の不活性型構造が解明された。また、同研究で新たに見つかったドパミンD2受容体に特有の空洞に結合する化合物は、類似する他のアミン受容体には結合しにくいと考えられる。そのため、同研究成果は、副作用の少ない抗精神病薬の合理的な開発・設計に役立つと期待される。
「ドパミンD2受容体を活性化する化合物は、パーキンソン病の治療薬になる。そのため、本研究により取得されたドパミンD2受容体の構造情報は、パーキンソン病の治療薬の合理的な探索・設計にも役立つ可能性がある」と、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構(AMED)プレスリリース



