記憶書き換えの細胞内分子メカニズムにKIF17はどう関わっているのか?
東京大学は12月21日、キネシン分子モーターKIF17による受容体輸送が神経活動を契機としてKIF17の分解により一時的に廃止され、その後すぐに樹状突起内において再開されるということを発見したと発表した。この研究は、同大大学院医学系研究科分子細胞生物学専攻の廣川信隆特任教授、岩田卓特任研究員、森川桃特任研究員(研究当時、現・理化学研究所)、武井陽介准教授(研究当時、現・筑波大教授)らの研究グループによるもの。研究成果は、「Science Advances」に掲載されている。
画像はリリースより
神経細胞内における記憶の書き換えメカニズムの解明は、心的外傷後ストレス障害(PTSD)を代表とする記憶障害を伴った精神疾患の治療開発において重要な役割を担っているが、実際に神経細胞がどのように記憶の書き換えや恐怖記憶の消去を行っているかについては、現在十分には理解されていない。
キネシンスーパーファミリータンパク質(KIFs)は、細胞内物質輸送を担う分子モーターであり、受容体等の機能分子の局在や活性を制御することで脳の高次機能の基盤となり、細胞の生死や機能を維持する上でも重要なタンパク質群。KIF17は、NMDA型グルタミン酸受容体を神経細胞の樹状突起内で輸送する分子モーターであり、廣川信隆特任教授のこれまでの研究から、主に記憶の獲得・想起などの神経可塑性において重要な役割を担っていることが明らかにされている。しかし、記憶の書き換えの基盤となる細胞内分子機構にどのように関わっているのかについては、これまで十分に理解されていなかった。
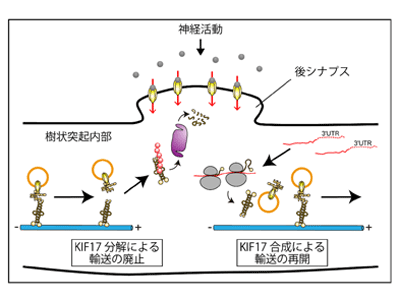
神経活動依存的なKIF17の局所タンパク質分解・合成を介した受容体輸送制御で調節
研究グループは、海馬由来培養神経細胞の活性を薬理学的に誘発した後のKIF17挙動の詳細な解析を行い、KIF17が神経活動依存的に急速に分解されていることを発見した。神経活動依存的なタンパク質分解には、プロテアソームが標的のポリユビキチン化タンパク質を認識して分解するユビキチンープロテアソームシステム(UPS)が関与しており、シナプス内でのタンパク質組成を調節していることが知られている。KIF17分解に関する詳細な解析を通して、UPSによりKIF17が神経活動依存的に分解されていることが判明した。また、同研究グループによるKIF17のセミ超高解像レーザー顕微鏡を使ったライブイメージングによる解析は、樹状突起に沿った輸送を行っている最中のKIF17が分解されていることを示したため、KIF17のタンパク質分解に伴って樹状突起内での微小管を基盤としたKIF17による分子モーター輸送が一時的に廃止されることがわかった。
一方、神経活動依存的な分解を受けた後のKIF17の挙動を再び追跡したところ、KIF17は分解後30分以内に発現量を上昇させ、元の発現量に戻ることがわかった。さらなる解析を進めるため、タンパク質発現量上昇に重要なmRNAの翻訳に着目。全ての細胞内では、核内の遺伝子からmRNAが転写され、タンパク質はmRNAから翻訳されることで生成され発現量を上昇させる。研究グループによる薬理学的・生化学的解析及びmRNAの局在イメージングは、KIF17が転写を介さずに翻訳されることでその発現量を上昇させ、むしろKif17 mRNAの細胞内総量は樹状突起内で特異的に減少していることを示した。
これらの実験結果から、刺激依存的なKIF17分解後の発現量上昇は樹状突起内でのKif17mRNAの翻訳によって起きていることが推測された。タンパク質合成が必須であるさまざまな可塑性を維持するためには局所的な合成が必要となる場合があり、神経刺激は3’側非翻訳領域(3’UTR)を介したメカニズムによって、神経突起に局在するmRNAの翻訳を制御するさまざまなシグナル伝達経路を活性化する。そこで、KIF17の3’UTRを蛍光タンパク質に結合させたものを海馬初代培養細胞に導入し薬理的に神経活動を誘発させたところ、樹状突起内での局所的なタンパク質合成が観察された。さらに詳細な薬理学的及び分子遺伝学的解析を通して、KIF17 3’UTRによって駆動される局所的なKIF17の合成は翻訳抑制因子であるPAIP2Aというタンパク質の神経活動依存的なタンパク質分解によって起動していることがわかったという。樹状突起内で局所合成されたKIF17は、セミ超高解像レーザー顕微鏡を使ったライブイメージングによる解析を行ったところ、樹状突起に沿ってNMDA型グルタミン酸受容体を輸送する様子が観察された。したがって、分解により一時的に廃止されたKIF17輸送は神経活動依存的なKIF17の局所合成に伴って合成された場所を起点として再開されるということが判明した。
最後に、今回の研究によってKIF17局所翻訳に必須であることがわかったKif17 3′UTRをマウスの海馬内の神経細胞から欠失させると、恐怖記憶の消去に重大な障害がもたらされた。また、ウイルスを介した神経細胞へのKif17 3’UTRの導入によって恐怖記憶の消去における障害は回復し、正常な記憶消去を観察することができたという。
記憶の書き換え障害が関与するPTSD等の精神疾患治療に新たな戦略をもたらす可能性
これらの結果から、分子モーターKIF17は神経活動依存的なタンパク質分解・合成による発現量制御に伴って、KIF17による樹状突起内での受容体輸送も神経活動によって調節されているということが示唆され、この局所的なKIF17輸送制御は認知や記憶の改変などの高次脳機能において重要な役割を担っているということがわかった。
研究グループは、「本研究は、キネシンの局所的な分解・合成による樹状突起内受容体輸送の制御を介して、神経活動が樹状突起内の受容体分布を調節するという新たな分子機構を提示するものであり、単一の樹状突起を記憶のユニットとして考える樹状突起可塑性の理解に役立つと考えられ、記憶の書き換え障害が関与するPTSD等の精神疾患治療に新たな戦略をもたらすものである」と、述べている。
▼関連リンク
・東京大学大学院医学系研究科・医学部 広報・プレス情報






