nSMase2/Smpd3遺伝子、DMDの骨格筋壊死改善やストレス応答に関連
国立精神・神経医療研究センター(NCNP)は12月10日、エクソソーム形成、スフィンゴミエリン分解、セラミド合成などに関わるnSMase2/Smpd3遺伝子がデュシェンヌ型筋ジストロフィー(DMD)の骨格筋壊死の改善やストレス応答に関わることを明らかにしたと発表した。この研究は、NCNP神経研究所RI管理室の松坂恭成研究員、橋戸和夫室長らの研究グループによるもの。研究成果は、英国のオンライン総合学術雑誌「BMC Medicine」に掲載されている。
DMDは、X染色体短腕(Xp21)上に存在するジストロフィン遺伝子の突然変異が原因で発症する進行性の筋肉の病気。DMD患者は5歳以後、緩徐に運動能力の低下が進行し、10歳頃に車椅子生活となり15歳頃に寝たきり状態に、20歳前後で呼吸障害や心不全で死に至る。現在、根本的な治療法は確立されていないのが現状だ。
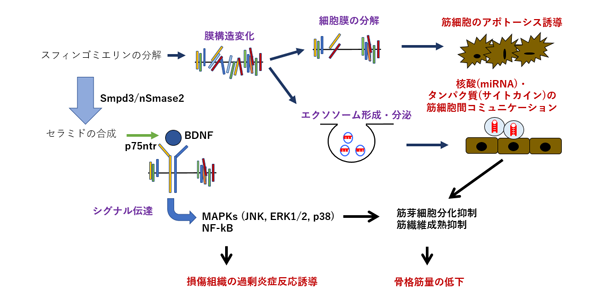
nSMase2/Smpd3遺伝子がコードするSmpd3タンパク質(以下、Smpd3)は、細胞膜上でスフィンゴ脂質をセラミドに加水分解する酵素で、エクソソーム形成や細胞内膜輸送、受容体からの情報伝達など多様な細胞内反応に関わり、赤血球の分化、脳における記憶形成、腫瘍の増殖などの生命現象において重要な役割を果たすことが知られている。一方で、Smpd3は骨格筋にも存在するものの、その骨格筋における働きや、DMDの病気の進行との関連はわかっていなかった。
そこで今回、研究グループは、DMDの進行によって変化するmicroRNAsがエクソソーム内に含まれることに着目。エクソソーム産生に関わるSmpd3遺伝子についての研究を実施した。
画像はリリースより
Smpd3遺伝子の機能阻害でDMDに特徴的な異常な筋病理像改善、マウスで確認
まず、DMDモデルマウスにおいて、Smpd3遺伝子をノックアウトしてその機能を阻害。その結果、過剰な炎症作用、筋細胞のアポトーシス、筋幹細胞の分化、などのDMDに特徴的な異常な筋病理像が全て改善され、骨格筋の筋膜損傷や筋力、運動能力も改善することが観察された。このことから、DMD病態進展には、Smpd3遺伝子が関わっていること、Smpd3によるエクソソーム放出が関わっていることが明らかになった。
また、DMDモデルマウスにおける不安様行動もSmpd3遺伝子のノックアウトによって軽減されたことから、エクソソームによるmicroRNAsの脳への伝播がDMDにおける脳症状に関与している可能性が示唆された。これは、DMDが単なる筋肉の病気ではなく、microRNAが血液を介して全身を循環するという「循環RNA疾患」である、という新しい疾患概念につながるものだという。
効果的で安全性の高い治療法確立に期待
今回の研究により、Smpd3遺伝子はDMD病態のさまざまな過程に関わることが明らかになった。しかし、Smpd3は生体内で多様な機能を果たしているが、これらのどの機能がどのようにDMD病態のどの場面で作用しているのかは未だ不明なままだ。
Smpd3がどの組織・細胞でどのような機能によってDMD病態を制御しているのかを明らかにすることによって、DMD病態の全貌を捉えられる可能性があり、より効果的で安全性の高い治療法の確立につなげることができると期待される、と研究グループは述べている。



