HTSをiPS/ES細胞由来NNS疾患モデルで実施
京都大学iPS細胞研究所(CiRA)は10月15日、iPS/ES細胞を用いたハイスループットスクリーニング(HTS)により、中條・西村症候群(Nakajo-Nishimura syndrome:NNS)の病態を改善する効果的な化合物の特定に成功したと発表した。この研究は、同研究所臨床応用研究部門、大学院医学研究科の加瀨直也大学院生、同大CiRA同部門の齋藤潤准教授らの研究グループによるもの。研究成果は、米国科学誌「STEM CELLS Translational Medicine」に掲載されている。
画像はリリースより
NNSは、幼少期から発熱や発疹を繰り返す自己炎症性疾患の一種であり、脂肪や筋肉の萎縮も併発する難病だ。現行の治療は、発熱や発疹を抑えるためにステロイドが用いられているが、これは脂肪や筋肉の萎縮には効果がなく、副作用も重篤であるため、有効な治療薬が望まれている。
研究グループは、先行研究により、NNSの発症メカニズムの解明と有効な治療法開発のため、iPS/ES細胞を用いたNNS疾患モデルの作製に成功している。今回は既存の化合物の中からNNSの治療薬候補となる化合物を探索するため、網羅的に化合物を評価するHTSを、iPS/ES細胞由来のNNS疾患モデルにより実施した。
HDAC阻害剤CUDC-907、MCP-1とIP-10の過剰産生を効果的に抑制
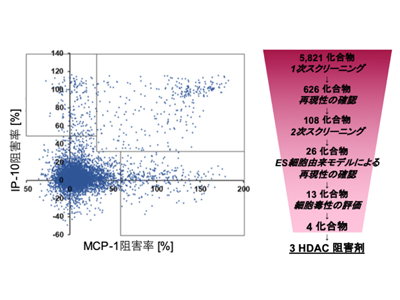
まず、NNS患者由来iPS細胞によるNNS疾患モデルを用いて、5,821化合物をHTSにより評価。NNSの患者で過剰に産生されるMCP-1およびIP-10を効果的に抑制した化合物をヒット化合物とし、さらにES細胞由来の疾患モデルを用いた再現性の確認や、細胞毒性が高い化合物を取り除くことにより、最終的に3種のHDAC阻害剤をヒット化合物として特定することに成功した。
次に、スクリーニングにより得られた3つのHDAC阻害剤の中で、最も阻害効果の高いCUDC-907の効果を詳細に検討。患者由来iPS細胞によるNNS疾患モデルおよび患者由来線維芽細胞に対しCUDC-907を処理したところ、患者由来の過剰なMCP-1およびIP-10の産生が効率的に抑制され、その産生量は健常レベルもしくはそれ以下にまで達した。
CUDC-907作用段階はMCP-1とIP-10の転写後
続いて、CUDC-907による副作用の可能性を確認するため、その細胞毒性を詳細に評価。CUDC-907を短期間(24時間)処理した細胞は、その細胞毒性はほとんど確認されなかった。しかし、長期間(15日間)処理した細胞はその増殖が顕著に抑制された。以上のことから、患者への長期的なCUDC-907の投与は、副作用を生じる可能性が示唆された。
最後に、CUDC-907がMCP-1およびIP-10の産生過程のうちどのポイントを阻害するのかを検討。疾患モデルにおけるMCP-1およびIP-10のmRNA発現量は、CUDC-907によりむしろ増加したが、翻訳されたタンパク質量は減少していた。以上のことから、CUDC-907が作用する段階は、少なくとも転写後であると明らかになった。
副作用の可能性あり、今後のメカニズム解明でNNSへの新規治療開発に期待
今回の研究では、NNS患者由来iPS細胞によるNNS疾患モデルを用いHTSを行うことで、NNSの病態を効果的に改善する化合物を特定することができた。
CUDC-907をNNS疾患モデルに処理すると、過剰なケモカインMCP-1およびIP-10の産生が健常レベルかそれ以下にまで抑制された。また、CUDC-907の短期間の処理は細胞毒性を示さなかったが、長期間の処理は細胞の増殖を抑制し、副作用を生じる可能性が示唆された。さらに、CUDC-907がMCP-1およびIP-10を阻害するポイントは、少なくとも転写後の段階であることが明らかとなった。
CUDC-907は、今回の研究より、副作用が生じる可能性が示唆されたため、直接治療薬として用いることは難しいと考えられるが、今後その阻害メカニズムが詳細に解明されることで、NNSに対する新たな治療戦略を見出すことが期待される。また、今回の研究では、自己炎症性疾患に対する治療薬候補の探索に、iPS/ES細胞を用いたHTSが有効な方法であると証明されたため、他の自己炎症性疾患への応用が期待される、と研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) プレスリリース




