独自のNMR技術で抗アポトーシスタンパク質Bcl-xLを解析
日本医療研究開発機構(AMED)は10月5日、核磁気共鳴(NMR)技術により、リガンドが結合していない状態において、PPI阻害剤の標的となるタンパク質に僅かな割合で存在するクリプトサイトを同定し、同定したクリプトサイトをリガンド非存在下で安定に存在させる変異体を構築することで、中分子を含むPPI阻害剤の探索を容易にする新たな戦略を確立することに成功したと発表した。これは、理化学研究所生命機能科学研究センターおよび次世代天然物化学技術研究組合の嶋田一夫チームリーダー、同組合の水越弓子研究員、産業技術総合研究所細胞分子工学研究部門の竹内恒研究グループ長と徳永裕二研究員、第一三共RDノバーレらの研究グループによるもの。研究成果は「Science Advances」に掲載されている。
画像はリリースより
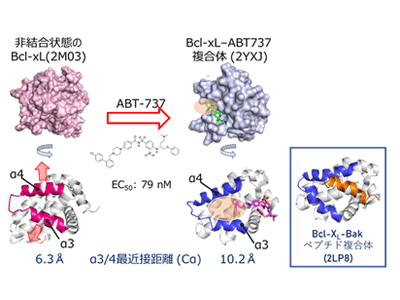
タンパク質の柔軟な構造変化は、PPI阻害剤の親和性と特異性において、重要な役割を果たすことが知られている。特に、「クリプトサイト」と呼ばれる、普段は閉じているが薬剤が結合したときに形成される隠れた薬剤結合部位は、リガンドの親和性を改善する特徴があることから、その利用が期待されている。しかし、これまでクリプトサイトの多くは、発見されたリガンドと標的タンパク質との複合体構造解析が行われることで、後から偶然発見されることが多く、クリプトサイトをあらかじめ探し当て創薬に活かすことはできていなかった。
研究グループは今回、抗がん活性を持つPPI阻害剤ABT-737の標的であり、クリプトサイトが見出されている抗アポトーシスタンパク質Bcl-xLを、NMR法により解析した。
F143W変異体を用いることで、スクリーニング効率が向上
まず、非結合状態における温度依存性解析や緩和分散解析を行ったところ、Bcl-xLは薬剤が結合していない状態でも、クリプトサイトが閉じた構造と開いた構造との平衡にあり、10%以下の低い割合で開いた構造を取ることが明らかとなった。また、クリプトサイトの開口にともないアロステリックな化学シフト変化を示したα5/α6へリックス領域に存在するPhe143に着目し、変異導入に伴う化学シフト変化を指標に、クリプトサイトを開口状態に安定化するアロステリック変異体を見出した。
見出されたF143W変異体は、構造平衡におけるクリプトサイトが開いた状態の構造の割合が大幅に増大していることが予想され、等温滴定カロリメトリー(ITC)を用いた結合実験により、本来のリガンドであり、クリプトサイトに結合するBakペプチドへの親和性が増大することが明らかとなった。
さらにクリプトサイト安定化変異体を用いることで、クリプトサイトに結合するリガンドのスクリーニングを効率化できると考え、ファージディスプレー法による検討を行った。その結果、F143W変異体を用いると、野生型よりも結合活性を示すクローンが高頻度で見出され、スクリーニング効率が向上することが確認できたという。
クリプトサイトの特定・安定化戦略は、PPI阻害剤の探索に貢献
得られたペプチドリガンドのNMR滴定実験を行ったところ、野生型のBcl-xLのクリプトサイトに結合していることが示唆された。このことは、NMR法を用いた構造平衡の制御により、PPI阻害剤の標的タンパク質のドラッガビリティを改善できることを示している。また、PPIを形成するタンパク質の約半数がクリプトサイトを持つとの試算もあることから、同研究において確立したクリプトサイトの特定・安定化戦略は、PPI阻害剤の探索に広く資するものと考えられる。
「クリプトサイトは、これまで、発見されたリガンドと標的の複合体構造解析により発見されてきた。しかし、クリプトサイトをあらかじめ発見・活用する手段が開発できれば、創薬標的の枯渇を解決する切り札の一つになると考えられる」と、研究グループは述べている。
▼関連リンク
・日本医療研究開発機構 プレスリリース






