大腸幹細胞の機能を損なう環境ストレスや保護システムは?
東京医科歯科大学は9月4日、慢性的なインターフェロン刺激が大腸幹細胞の枯渇や機能低下の原因になることを発見したと発表した。この研究は、同大難治疾患研究所生体防御学分野の樗木俊聡教授らの研究グループが、理化学研究所生命医科学センター粘膜システム研究チームの大野博司チームリーダーらとの共同研究として行ったもの。研究成果は、「Scientific Reports」のオンライン速報版に掲載されている。
画像はリリースより
I型インターフェロン(IFN)は、ウイルスや細菌感染の際、体に抵抗性を付与する重要なサイトカイン。IFNは、何ら感染のない個体でも常に微量産生されており、この微量なIFNの刺激は、いざ感染が起こったときに効率よく免疫応答を発動するために重要だ。研究グループはこれまで、持続的なIFN刺激が造血幹細胞や小腸幹細胞の数の減少や機能低下を誘導すること、IFNシグナルを負に制御する転写因子IRF2が当該IFN刺激を適度に調節することによってそれら幹細胞の数や機能を維持していることを報告してきた。
大腸上皮層は、腸内細菌や腸に感染する病原体に対するバリアーとして機能しているため、その恒常性は厳密に保たれる必要がある。大腸幹細胞(colonic stem cell、CoSC)は、大腸陰窩の底部に局在し、Lgr5を発現している。CoSCは、定常状態における大腸上皮の恒常性維持と障害を受けた大腸上皮の再生に不可欠だ。また、CoSCの維持には Wnt、Notchリガンド、EGF(epidermal growth factor)等のニッチ因子が重要だ。しかしながら、CoSCの機能を損なう環境ストレスや同ストレスから幹細胞性を保護するシステムはよくわかっていなかった。
慢性IFN刺激でCoSCは自己複製能低下+TA細胞分化促進、IRF2が適切に制御
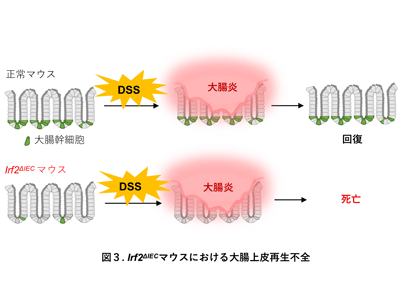
研究グループは、IFNシグナルを負に制御する転写因子IRF2を腸上皮細胞(IEC)特異的に欠損する(Irf2ΔIEC)マウスを用いてCoSCを解析。その結果、コントロールマウスと比較して、CoSCの数が著しく減少していること、CoSCの大腸上皮再生能の指標となるオルガノイド形成能が低下していることを見出した。Irf2ΔIECマウスでは、CoSCから transit-amplifying(TA)細胞への分化が亢進しており、これがCoSC数減少の原因であることが示唆された。
さらに、デキストラン硫酸ナトリウム(DSS)を投与して大腸炎を誘導すると、Irf2ΔIECマウスでは、コントロールマウスと比較して、大腸上皮の再生がほとんど起こらず、大腸炎による体重減少が顕著で、マウスが死亡することが明らかになった。また、野生型マウスに、IFN誘導剤である poly(I:C)を低濃度で長期投与すると、Irf2ΔIECマウスと類似のCoSCの機能低下が観察された。以上のことから、慢性的なIFN刺激は、CoSCの自己複製能を低下させると同時にTA細胞への分化を促すこと、その結果としてCoSCの数が減少することが明らかになった。また、転写因子IRF2は、IFNシグナルを適性に制御することによって 機能的CoSCを維持していることが判明した。
機能的大腸幹細胞の維持、炎症性腸疾患の発症原因解明に新たなヒント
これまでに研究グループは、持続的なIFNシグナルが造血幹細胞および小腸幹細胞の自己再生能力を低下させ、それぞれ造血前駆細胞および分泌前駆細胞への分化を促進することを報告した。一方、ウイルス感染時のIFNシグナルは、腎臓、小腸、唾液腺等の上皮細胞の再生を促進することで、感染細胞の排除と組織修復を効率的に進めることが示唆される。他方、IFN シグナルが持続すると、細胞ストレスとして機能し、造血幹細胞、小腸幹細胞、そして大腸幹細胞の自己再生能力が低下する。今回の発見は、IFNがマウスおよびヒトの多様な組織幹細胞に同様の効果を及ぼす可能性があることを示唆している。
I型IFNはウイルス性肝炎および多発性硬化症の治療に使用されてきた経緯があり、一部の患者がI型IFN治療中に潰瘍性大腸炎やセリアック病を患っていることから、慢性的なIFN治療は腸上皮の脆弱性を引き起こす可能性がある。研究グループは、「今回の研究は、生涯にわたって機能的な大腸幹細胞を維持するための分子メカニズムに対する新しい知見を提供し、炎症性腸疾患の発症原因解明に貢献するものだ」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



