新型コロナに対するメインプロテアーゼの原子レベルでの作用機序は?
東京工業大学は8月20日、スーパーコンピュータTSUBAME3.0を用いた分子動力学シミュレーションにより、新型コロナウイルス(SARS-CoV-2)の複製に関わる酵素「メインプロテアーゼ」の機能を阻害する治療薬の候補となる化合物が満たすべき、ファーマコフォアのモデリングに成功したと発表した。この研究は、同大情報理工学院 情報工学系の関嶋政和准教授を中心とする、同大物質・情報卓越教育院の安尾信明特任講師、筑波大学 医学医療系 生命医科学域の吉野龍ノ介助教の研究グループによるもの。研究成果は、国際雑誌「Scientific Reports」に掲載されている。
画像はリリースより
創薬には、十数年に渡る長い期間と3000億円以上とも言われる膨大な研究開発費が必要であり、近年はこの費用が増加傾向にある。これまで、新規化合物獲得のための期間と費用を削減し、有望な薬候補化合物を効率的に探索するためにさまざまな手法、アプローチが開発されてきた。
新型コロナウイルス感染症(COVID-19)の感染者数は2020年8月初旬に1800万人を超え、今も感染が拡大を続けるなか、世界中で治療薬の探索が続いている。従来、SARSウイルス(SARS-CoV)の複製に関わるメインプロテアーゼに対して、ペプチド様抗HIV-1薬が有効であることが報告されていた。SARS-CoVとSARS-CoV-2の間には密接な系統的関係があるため、これらのメインプロテアーゼは多くの構造的・機能的特徴を共有している。そのため、ペプチド様抗HIV-1薬はSARS-CoV-2でも、メインプロテアーゼを標的とする薬剤の候補として考えられているが、SARS-CoV-2のメインプロテアーゼの原子レベルでの作用機序は、これまで明らかになっていなかった。
ファーマコフォアのモデリングに成功、α-ケトアミド阻害剤で正しさも確認
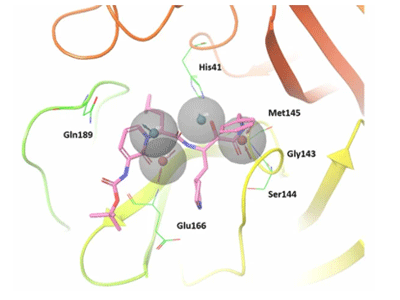
研究グループは今回、スーパーコンピュータTSUBAME3.0を用いて、1マイクロ秒の時間スケールでの分子動力学(MD)シミュレーションを実施することで、SARS-CoV-2のメインプロテアーゼと3種類の薬剤候補化合物との重要な相互作用を明らかにし、ファーマコフォアをモデリングすることに成功した。
MDシミュレーションとは、タンパク質をつくっている原子や、周囲の水などの溶媒の動きを再現するシミュレーション手法。原子ごとにニュートンの運動方程式を数値積分で解いていき、原子に働く力を求め、原子ごとの速度・座標の更新を行っていく。
一方、ファーマコフォアは、同じ標的タンパク質の同じ部位に結合する医薬品による機能阻害に必要な官能基群の3次元配置をモデル化したもので、分子動力学シミュレーション等のシミュレーション手法に比べ、ファーマコフォアモデルを満足する化合物の探索を短時間で行うことができる。
今回、全てのMDシミュレーションにおいて、SARS-CoV-2のメインプロテアーゼの41番目のHis(ヒスチジン)、153番目のGly(グリシン)、166番目のGlu(グルタミン酸)が、化合物の同じ官能基と相互作用を形成していた。この結果は、相互作用がSARS-CoV-2のメインプロテアーゼに作用する薬剤の重要なターゲットであることを示唆しているという。
次に、モデリングしたファーマコフォアの正しさを検証するため、SARS-CoV-2のメインプロテアーゼの機能をIC50=0.67±0.18μMで阻害することが知られているα-ケトアミド阻害剤が、このファーマコフォアに適合するか調べた。その結果、α-ケトアミドの1つの水酸基と2つのカルボニル基がファーマコフォアモデルと一致していることが確認された。
ファーマコフォアに基づき、COVID-19の治療薬候補となる化合物探索を目指す
SARS-CoVには、メインプロテアーゼの145番目のCys(システイン)と共有結合する不可逆性阻害剤が数多く知られており、これらは競合阻害剤よりも高い結合親和性を有している可能性がある。しかし、COVID-19のような緊急性の高い疾患には、薬剤のリポジショニングが有効であり、同研究で提案されたファーマコフォアは、Cysと共有結合を形成するために官能基を含まない化合物を評価することを可能にしている。
今後は、このファーマコフォアに基づき、シミュレーションと統計的機械学習などの人工知能(AI)や生化学実験を組み合わせたスマート創薬によって、COVID-19の治療薬候補となる具体的な化合物探索を目指していくと、研究グループは述べている。
▼関連リンク
・東京工業大学 ニュース



