腸幹細胞が自己複製しつつ上皮細胞へ分化する、バランス調節の仕組みは不明だった
東京医科歯科大学は7月21日、持続的なインターフェロン刺激が腸幹細胞の枯渇や機能低下の原因になることを発見したと発表した。この研究は、同大学・難治疾患研究所・生体防御学分野の樗木俊聡教授らの研究グループによるもの。研究成果は、「Nature Cell Biology」のオンライン速報版に掲載されている。
画像はリリースより
I型インターフェロン(以下、IFN)は、ウイルス感染や細菌感染の際、宿主に抵抗性を付与する重要なサイトカインとして知られている。IFNは、何ら感染のない宿主でも、微量ではあるものの恒常的に産生されており、この微量なIFNの刺激が、いざ感染が起こったときに効率よく免疫応答を発動するために重要だ。これまでに研究グループは、持続的なIFN刺激が血液の源である造血幹細胞(hematopoietic stem cell:HSC)の減少や機能低下を誘導すること、IFNシグナルを負に制御する転写因子IRF2が当該IFN刺激を適度に調節することによってHSCの数や機能を維持していることを報告してきた。
腸管上皮は、栄養や水分の吸収に加えて、腸内細菌から生体を保護する粘膜バリアとして大切な役割を担っている。陰窩には腸再生の源として腸管上皮幹細胞(intestinal stem cell:ISC)が存在しており、ISCは自分自身を再生しつつ(自己複製能)、吸収上皮や分泌上皮等新しい上皮細胞を供給することで(多分化能)、腸管上皮の恒常性を維持している。しかし、自己複製能と多分化能のバランスを適性に調節するメカニズムはわかっていなかった。
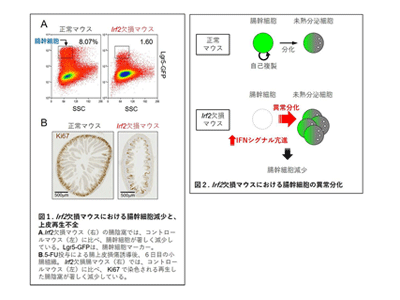
IFNシグナルの適切な制御が、ISCの自己複製能と分泌上皮細胞への分化のバランスを調整し機能を維持
研究グループは今回、IFNシグナルを負に制御する転写因子IRF2を欠損する(Irf2-/-)マウスまたは腸上皮細胞(IEC)特異的にIrf2を欠損する(Irf2ΔIEC)マウスでは、コントロールマウスと比較して、ISCが著しく減少することを発見した。それらマウスでは、定常状態におけるIECの恒常性は保たれていたが、5-FUを投与して腸損傷を誘導すると、腸上皮の回復・再生能が著しく低下していた。また、野生型マウスに、IFN誘導剤であるpoly(I:C)を低濃度で長期投与あるいはリンパ球性脈絡髄膜炎ウイルスclone13(LCMVC 13)を慢性感染すると、ISCの機能が低下した。さらにIrf2-/-マウスやLCMV C13を慢性感染させた野生型マウスでは、腸陰窩底部で未熟なパネート細胞が大量に観察された。
これらの結果から、持続的なIFN刺激は、ISCの自己複製能と多分化能のバランスを偏向させ、自己複製能が低下して分泌細胞への分化を促すことが明らかになった。また、転写因子IRF2は、IFNシグナルを適性に制御することによって、ISCの自己複製能と分泌上皮細胞への分化のバランスを調整し、ISCの機能を維持していることが明らかになった。
IFNシグナルの異常を介した疾患の発症原理解明に寄与する可能性
今回の研究成果により、何ら感染のない定常状態においても、IRF2が分泌上皮細胞への分化を適度に制限することによってISCの機能を維持していること、ただし、IFNシグナルが慢性的になると、組織幹細胞は徐々に自己複製能を失い幹細胞数が減少して腸上皮の脆弱性につながることが示唆された。また、ウイルス性肝炎や脳の自己免疫疾患である多発性硬化症の治療にIFNが使用されてきたが、その際、副作用として炎症性腸疾患やセリアック病を発症するケースが報告されている。これは、IFN治療による免疫系の過剰な活性化のみならず、腸上皮組織そのものの脆弱化の結果である可能性が考えられる。また、IFNシグナルの異常は、全身性エリテマトーデスなどの自己免疫疾患の発症に関わることも知られている。
研究グループは、「本成果は、IFNシグナルの異常を介したさまざまな疾患の発症原理に新たな示唆を与えるものだ。また、今回明らかになったIFN調節システムは、腸上皮以外の上皮組織でも働いている可能性があり、新たな幹細胞維持システムとして今後の展開が期待される」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



