CALHM1のATP放出による味覚情報伝達のメカニズムは?
東京大学は7月18日、CALHM1およびそのファミリーの立体構造を、クライオ電子顕微鏡を用いた単粒子解析法によって決定し、決定した立体構造から、CALHM1のATP透過機構およびCALHMファミリーの多量体化の構造基盤が明らかになったことを発表した。この研究は、同大大学院理学系研究科の濡木教授らのグループと京都府立医科大学の樽野教授らのグループとの共同研究によるもの。研究成果は、「Science Advances」のオンライン版に掲載されている。
画像はリリースより
ヒトを含む多くの哺乳類は、甘味・うま味・苦味・酸味・塩味といった基本味を舌に存在する味蕾を用いて認識している。このうち、甘味・うま味・苦味は味蕾細胞の細胞膜に発現するGタンパク質共役受容体によって受容され、細胞内のシグナル伝達カスケードを活性化し、最終的に神経伝達物質であるATPがチャネルを通って細胞から放出されることで、P2X受容体を発現する求心性の味神経へ味覚情報を伝達する。このATP放出過程には、イオンチャネルの一つであるCALHM1が必須となる。
CALHM1は、脱分極または細胞外Ca2+濃度の減少によって活性化し、Ca2+やATPなどの小分子を透過させる。活動電位に依存した細胞からのATP放出の多くは、チャネルではなくシナプス小胞によって行われており、CALHM1は現在同定されている中では唯一の電位依存性ATPチャネルだ。また、ヒトCALHM1の遺伝子多型(P86L)は、哺乳類細胞におけるCa2+透過性の減少およびアミロイドβの蓄積との関連が報告されており、アルツハイマー病との関わりが明らかとなっている。
しかし、これまでCALHM1 がどのような孔(ポア)を形成してATP を透過させるのか、また、CALHM1のホモログも同様の構造をとっているのかなど、立体構造に基づく詳細なポアの透過機構や、CALHM1のホモログの構造、多量体の形成機構などは謎に包まれたままだった。
CALHM1のN末端がATPの放出に関与、チャネル閉鎖には他の領域も関与
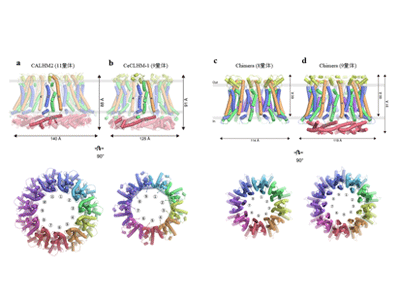
今回、研究グループは、クライオ電子顕微鏡を用いた単粒子解析法により、ヒトCALHM1と60%程度の配列類似性を持つメダカ由来CALHM1、ヒト由来CALHM2、および線虫のホモログであるCeCLHM-1の立体構造を明らかにした。
CALHM1単量体は4本の膜貫通へリックスからなり、それが8量体のチャネルを形成することが明らかとなった。膜貫通ヘリックスのトポロジーは新しく、C末端は細胞質側に伸びてαへリックスを形成し、多量体間の相互作用に寄与していた。N末端は各単量体からリング状構造の中心にのびてαヘリックスを形成しており、この8つのヘリックスがチャネルのポア部分を形成していることが示唆された。
そこで、ポア部分にあたるN末端のアミノ酸残基を欠失させた変異体を作製し、培養細胞を用いてCALHM1のATP放出能欠失の効果を評価した。細胞外にCa2+が存在しない開状態では、変異体のATP放出活性は野生型と比較して著しく上昇したことから、N末端のαへリックス(NTH)がATPの放出において重要な機能を果たしていることが示唆された。一方で、細胞外にCa2+が存在する閉状態では、欠失変異体も野生型同様、ATP放出活性をほとんど示さなかった。これらの知見から、CALHM1構造中のN末端は実際にATPの放出に関与するが、チャネルの閉鎖には構造中の他の領域も関与していることが示唆された。
多量体化メカニズムも解明、ADなどCALHMファミリー関連の疾患や味覚研究の進展に期待
一方、CALHM2 とCeCLHM-1の構造では、膜貫通部分のトポロジーはCALHMファミリー間で類似しているものの、C末端領域の構造はそれぞれ異なっていた。また、各々11量体と9量体を形成しており、CALHMファミリー間で異なる量体数が存在することを示した。
さらに、量体数を決定する構造基盤を解明するために8量体のCALHM1と11量体のCALHM2のキメラタンパク質を作製し、クライオ電子顕微鏡を用いた単粒子解析法により構造解析を行った結果、8量体と9量体という異なる量体数の構造が得られた。キメラタンパク質はCALHM1の膜貫通部分とCALHM2のC末端領域からなるため、膜貫通ドメインでの相互作用が量体数の規定に寄与していることが明らかとなった。
今回の研究により、CALHMチャネルのATP透過機構および多量体化のメカニズムが解明されたことで、今後、アルツハイマー病などのCALHMファミリーに関連した疾患や味の感受に関わる研究が進展していくことが期待される。
▼関連リンク
・東京大学大学院理学系研究科・理学部 プレスリリース




