生体はさまざまな細胞死を誘導して感染を防ぐがその機構の多くは未解明
東京医科歯科大学は7月13日、下痢症の主要な原因菌である赤痢菌が宿主細胞死アポトーシスとネクロプトーシスのクロストークを阻害することで感染を拡大させる生存戦略をつきとめたと発表した。この研究は、同大大学院医歯学総合研究科細菌感染制御学分野の芦田浩准教授と鈴木敏彦教授の研究グループが、千葉大学真菌医学研究センターの笹川千尋特任教授との共同研究として行ったもの。研究成果は、「EMBO Journal」のオンライン版に掲載されている。
病原細菌の感染に対し、生体はさまざまなタイプの細胞死(アポトーシス、ネクローシス、パイロプトーシス等)を誘導することで感染の拡大を妨げる。細胞死は感染により損傷を受けた細胞を病原細菌ごと取り除けるため、感染防御機構として効果的だ。これに対し、赤痢菌をはじめとする腸管病原菌はIII型分泌装置と呼ばれる病原因子輸送装置より複数の病原性タンパク質(エフェクター)を宿主細胞に分泌し、上皮細胞の細胞死を抑制することで増殖の場を保持して感染を成立させる。しかし、感染における宿主の細胞死誘導機構および赤痢菌による細胞死抑制戦略は多くが未解明のままだ。
画像はリリースより
赤痢菌はアポトーシスを阻害、宿主はさらにネクロプトーシスを誘導するがそれも阻害
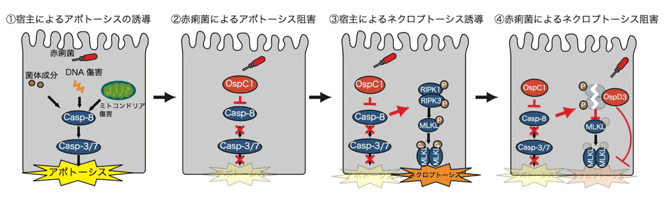
今回、研究グループは、赤痢菌による細胞死抑制機構を解明するため、複数のエフェクター遺伝子欠損赤痢菌株を感染させた上皮細胞での細胞障害性を調べた。その結果、ospD3遺伝子欠損株感染細胞では野生株感染時に比べて細胞障害性が上昇することが示された。さらにospD3遺伝子欠損株感染細胞で誘導される細胞死を解析したところ、ネクロプトーシスであることがわかった。
続いて、OspD3エフェクターの宿主標的因子を探索したところ、OspD3エフェクターは自身の有するプロテアーゼ活性により、ネクロプトーシス誘導に必要なシグナル因子であるRIPK1およびRIPK3を標的とし、切断することが判明。この結果、ネクロプトーシス阻害により赤痢菌が増殖する足場が確保され、菌は細胞内で増殖を続けることが示唆された。
ネクロプトーシスはアポトーシス誘導に重要なcaspase-8の活性が阻害されている条件で誘導されることが知られている。多くの病原細菌はアポトーシスを阻害する感染戦略を有しており、実際に赤痢菌の腸管上皮細胞感染でもアポトーシスが阻害されている。そこで、研究グループは赤痢菌感染時のネクロプトーシス誘導が、赤痢菌によるcaspase-8依存的なアポトーシス阻害が原因ではないかと仮説を立てた。複数のエフェクター遺伝子欠損赤痢菌株を感染させた上皮細胞でのcaspase-8活性を測定したところ、ospC1遺伝子欠損株感染細胞では野生株感染時に比べてcaspase-8活性が上昇しており、アポトーシスも増加していることが認められた。実際にospC1遺伝子とospD3遺伝子の二重欠損株感染細胞ではospD3遺伝子欠損株感染で認められたネクロプトーシスの特徴であるMLKLのリン酸化および細胞障害性が消失していた。すなわち、赤痢菌OspC1エフェクターによるcaspase-8活性阻害がネクロプトーシス誘導の引き金となることが明らかとなった。
以上の結果をまとめると、宿主は赤痢菌感染を妨ぐため、caspase-8の活性化を介したアポトーシスを誘導する。これに対し、赤痢菌はIII型分泌装置よりOspC1エフェクターを腸管上皮細胞に分泌し、caspase-8活性化を阻害することでアポトーシスを抑制する。しかし、宿主は赤痢菌によるcaspase-8阻害を危険信号として感知し、バックアップ機構として第2の細胞死ネクロプトーシスを誘導する(細胞死クロストーク)。一方、赤痢菌はさらにネクロプトーシスを阻害するため、OspD3エフェクターを分泌し、RIPK1およびRIPK3を分解することでネクロプトーシスを抑制する。この結果、赤痢菌は感染の場となる腸管上皮内で増殖を続け、感染を拡大させる。このように、宿主と病原細菌の攻防において、宿主は病原細菌の感染を感知し、細胞死クロストークを誘導するが、赤痢菌はこの細胞死クロストークを抑制し、腸管上皮細胞で感染を拡大させる高度な生存戦略を有することが明らかになった。
腸管病原菌の感染機構解明で、ワクチンおよび新規治療薬開発への応用に期待
腸管病原菌による下痢症は国際的視野から重要な感染症だが、いまだに有効なワクチンは存在しない。また、現行の抗生剤治療では多剤耐性菌の出現が問題となっていることからも、新たな治療法の確立が不可欠となっている。今回の研究成果について研究グループは、「赤痢菌による新たな感染戦略を解明したことで、それを標的としたワクチンおよび新規治療薬開発につながることが期待されるとともに、本研究で解明されたエフェクター機能を利用し、細胞死に対する特異的阻害薬開発に大きく貢献することが期待される」と、述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



