腸内ウイルス叢の全容がわかれば、疾患特異的細菌の制御ができる可能性
大阪市立大学は7月11日、腸内細菌ゲノムと腸内ウイルスゲノムを網羅的に解析することで疾患特異的な腸内細菌の制御を可能とする新規抗菌物質の同定に成功したと発表した。この研究は、同大大学院医学研究科ゲノム免疫学の植松智教授(東京大学医科学研究所附属ヒトゲノム解析センターメタゲノム医学分野特任教授、附属国際粘膜ワクチン開発研究センター自然免疫制御分野特任教授を兼務)、藤本康介助教(東京大学医科学研究所附属ヒトゲノム解析センターメタゲノム医学分野特任助教、附属国際粘膜ワクチン開発研究センター自然免疫制御分野特任助教を兼務)、東京大学医科学研究所附属ヒトゲノム解析センター健康医療インテリジェンス分野の井元清哉教授らの国際共同研究グループによるもの。研究成果は、「Cell Host & Microbe」にオンライン掲載されている。
画像はリリースより
消化管内には細菌やウイルスをはじめとする常在微生物叢が存在し、健康に大きな影響を与えている。次世代シークエンサーなどゲノム解析技術の進歩に伴い、常在微生物叢解析が盛んに行われるようになった。特に、腸内細菌叢の乱れと疾患(肥満、糖尿病、関節リウマチ、炎症性腸疾患など)の関係性が明らかとなってきただけでなく、疾患の発症と直接的に関わる病原常在腸内細菌(共生病原菌、Pathobiont)も発見され、疾患の発症予防のために除菌が期待されている。しかし、抗生物質の使用は、有益菌も殺傷し、腸内細菌の乱れを助長する可能性があるため、Pathobiontだけを特異的に排除できる方法が求められている。
一方で、腸管内には細菌よりはるかに多い数のウイルスが存在している。常在腸内ウイルスは、インフルエンザウイルスのようにヒトに感染するウイルスではなく、腸内細菌を宿主とするバクテリオファージ(ファージ)が主となる。したがって、腸内ウイルスを解析することで、Pathobiontに感染可能なファージが同定され、その情報を基盤として新しいPathobiont の制御法が見出される可能性がある。
しかし、腸内ウイルスの網羅的な解析をするためには、全ゲノムシークエンスが必要であること、これまで腸内ウイルスの大規模なデータベースが存在していないため、ゲノム配列を取得してもレファレンスが非常に乏しく解析が難しいこと、さらに、ファージ学がファージの形態を基盤として発展してきた学問であるため、ゲノムによるファージ分類法が確立されていないことなどから、腸内ウイルス叢の全容はこれまでほとんど明らかとなっていなかった。
世界初となる、ヒト腸内ウイルス叢と細菌叢のメタゲノムデータベースの作成に成功
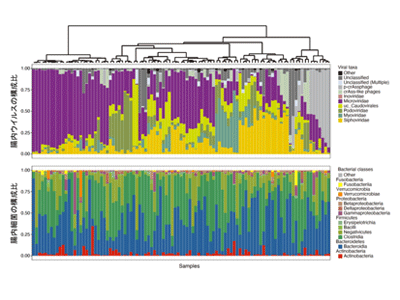
研究グループは今回、101人の日本人健常者の糞便サンプルから腸内細菌ゲノムと腸内ウイルスゲノムを抽出し、それぞれ全ゲノム解析を行った。これまで腸内ウイルス叢のゲノム解析手法が確立されていなかったため、東京大学医科学研究所のスーパーコンピュータ上でゲノムアセンブリを行い、擬似クローニングをすることで確度の高い腸内ウイルス解析パイプラインを構築した。その解析パイプラインを用いて健常者の腸内ウイルス叢を解析したところ、健常者の腸内ウイルス叢は個々人で非常にユニークな構成をしていることが明らかとなった。
腸内ウイルスの主となるファージは溶菌性ファージと溶原性ファージの2種類に大別され、それぞれ異なる生活環を呈する。溶菌性ファージは宿主細菌に吸着して感染した後、自身のゲノムを細菌に注入・複製し、溶菌することで娘ファージを菌体外に放出する。この時、細菌ゲノム内にCRISPR配列が挿入されることで、感染履歴が記憶される(細菌の防御応答)。一方、溶原性ファージは宿主細菌に感染し自身のゲノムを注入した後、宿主細菌のゲノムに自らのゲノムを組み込むことができる。この状態はプロファージと呼ばれ、宿主細菌とともに増殖することが可能となるだけでなく、宿主細菌が老化した場合などは溶菌性ファージと同様に菌体外へと放出される。
C. difficile特異的に感染するファージを同定し、そのゲノム情報から抗菌物質も同定
同研究では、得られたゲノム情報を利用して、腸内細菌と腸内ウイルスのプロファージ配列に着目した感染関係とCRISPR配列に着目した感染関係を同定する解析パイプラインを構築した。さらに、今回得られた健常者のシークエンスデータおよびこれまで臨床分離株として単離されているClostridioides difficile(偽膜性腸炎の起因菌として知られている菌)の17菌株のシークエンスデータを用いて、C. difficile特異的なプロファージ配列を抽出した。そのプロファージ配列から、ファージが菌体内で増殖した後に菌体外に放出される際に使用される溶菌酵素として知られるエンドライシンの配列を探索し、新規配列を複数同定した。それらのエンドライシンを合成し、in vitroで溶菌活性を有することを示しただけでなく、C. difficile感染マウスモデルにおいて今回新しく同定したエンドライシンが効果を示すことを明らかにした。同研究により、健常者の同一糞便における腸内ウイルス叢と細菌叢のメタゲノムデータベースを世界に先駆けて作成することができたという。
これまで解析が困難であった腸内細菌と腸内ファージの感染関係を明らかにすることで、C. difficileに対する新しい溶菌酵素を同定することができた。研究グループは、「この手法を疾患特異的な腸内細菌を標的として応用することで、新しい溶菌酵素の同定につながり、これまで制御できなかった腸内細菌叢の乱れに関連するさまざまな難治性の疾患に対する新たな治療アプローチとして使える可能性が期待される」と、述べている。
▼関連リンク
・大阪市立大学 新着情報



