DMDの細胞移植療法は、安全性と治療効果の両者を満たす移植用細胞がまだない
京都大学iPS細胞研究所(CiRA)は7月3日、ヒトiPS細胞から筋再生能のある骨格筋幹細胞を誘導する方法を確立したと発表した。この研究は、CiRA臨床応用研究部門の趙明明研究員、櫻井英俊准教授らの研究グループによるもの。研究成果は、「Stem Cell Reports」にオンライン掲載されている。
画像はリリースより
デュシェンヌ型筋ジストロフィー(DMD)は、筋肉にあるジストロフィンというタンパク質が欠損することによって発症する進行性の重篤な筋疾患で、根本的な治療法は開発されていない。ジストロフィンを骨格筋に再生する方法として細胞移植治療が期待されているが、生体由来の骨格筋幹細胞であるサテライト細胞の他家移植による治療では、治療効果が認められていない。また、他のグループの研究によって、Pax7という遺伝子を強制的に発現させ続けることで骨格筋幹細胞を多能性幹細胞から誘導する方法も開発されたが、遺伝子導入を行った細胞を移植するには現状では安全面で課題がある。
そこで、研究グループは、ヒトiPS細胞を段階的に骨格筋の発生過程をたどりながら分化させ、筋肉の高い再生能を持つ骨格筋幹細胞を誘導することを目指して研究を行った。
骨格筋の発生過程を段階的に追い、分化後期のMyf5陽性細胞にたどり着いた
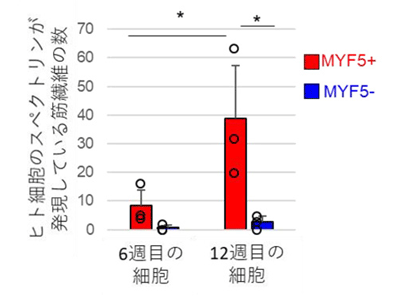
研究グループは、まず、段階的に発生過程をたどるためにPax3という遺伝子に注目し、初期の中胚葉発生過程をモニターすることで、ヒトiPS細胞から効率的に骨格筋前駆細胞を得られる方法を開発。この方法は、他の研究グループによって報告された方法よりも誘導効率が高かった。さらに骨格筋前駆細胞に特異的に発現する遺伝子の中でも、Myf5という遺伝子に着目したところ、発生過程初期(4週目)ではMyf5陽性細胞は円形の細胞で、発生初期の骨格筋前駆細胞と考えられるのに対し、発生過程後期(12週目)になると、融合して長く伸びた筋管細胞と同じ場所にMyf5陽性細胞が集まっていることがわかった。また、12週目には、Myf5陽性細胞がMyf5陰性細胞に比べて、Pax7など、サテライト細胞に特徴的な遺伝子も多く発現していた。
これらの結果を踏まえ、ヒトiPS細胞由来のMyf5陽性細胞とMyf5陰性細胞を、それぞれ30万個ずつ免疫不全マウスの前脛骨筋に移植すると、Myf5陰性細胞に比べてMyf5陽性細胞のほうが、移植後に筋線維を形成している度合いが高く、筋再生能が高いことが示唆された。また、発生過程初期(分化開始後6週目)と後期(12週目)の細胞を比べてみると、初期のMyf5陽性細胞に比べて、後期のMyf5陽性細胞のほうが移植後の筋再生能が高いことがわかった。この分化後期のMyf5陽性細胞は、筋再生能の高い胎児型の骨格筋幹細胞と似た遺伝子発現パターンを示していた。
分化後期のMyf5陽性細胞をDMDマウスに移植すると筋張力が改善
そこで、研究グループは、発生過程後期(12週目)のMyf5陽性細胞の移植効果を確認するため、DMDモデルマウスの前脛骨筋に30万個のMyf5陽性細胞を移植。すると、1匹あたり100本以上のジストロフィン陽性筋線維が再生されるのが確認された。一部のMyf5陽性細胞は、移植後にPax7陽性のサテライト細胞になっていると考えられたという。さらに、運動機能を評価するため、DMDモデルマウスの右腓腹筋に100~200万個のMyf5陽性細胞を移植。移植後6週のマウスの筋力を測定すると、弱いながらも有意な筋張力の改善効果が示された。
DMDの進行に伴って失われるジストロフィンを補うため、細胞移植療法が有効と目されているが、これまで、安全性と治療効果の両方において有用な移植用の細胞は見出されてこなかった。今回の研究では、骨格筋の発生過程を再現するという比較的臨床応用しやすいと考えられる方法で、ヒトiPS細胞から骨格筋前駆細胞を分化させる方法が確立された。さらに、Myf5遺伝子の発現の有無と発生段階の時期によって、筋再生能の高い胎児型の骨格筋幹細胞を抽出できることが明らかになり、実際にDMDモデルマウスでの移植効果が示された。研究グループは、「今後はこの手法を改良し、治療効果の高い細胞を安定して作製する方法を確立することを目指す」と、述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) ニュース




