LDL受容体が正しい立体構造を取らないと家族性高コレステロール血症に
東北大学は7月1日、ヒト低比重リポタンパク質(LDL)受容体が、細胞内で翻訳合成されつつ、正しい立体構造に折りたたまれていく様子を観察することに初めて成功したと発表した。この研究は、同大多元物質科学研究所の門倉広准教授、稲葉謙次教授らの研究グループによるもの。研究成果は、「米国科学アカデミー紀要(PNAS)」のオンライン版に掲載されている。
画像はリリースより
ヒトの体を構成している細胞は、細胞内で働くタンパク質だけでなく、細胞膜や細胞の外で働くタンパク質も多く作っている。このようなタンパク質は細胞表層タンパク質と呼ばれ、LDL受容体など、健康な生活を送る上で欠かせないさまざまなタンパク質が含まれる。細胞表層タンパク質の多くは、その分子内にジスルフィド結合と呼ばれる、2個のシステイン残基の分子内架橋構造を持つ。ジスルフィド結合は多くの細胞表層タンパク質が正しい構造に折り畳まれる上で極めて重要な役割を担っている。細胞表層タンパク質へのジスルフィド結合の導入は、ヒト細胞中ではPDIファミリータンパク質と呼ばれる一群の酵素によって触媒され、小胞体の中で進行する。しかし、ヒト細胞の小胞体に送り込まれてくる翻訳合成途上のタンパク質に、いつ、どのようにしてジスルフィド結合が導入されるのかについてはほとんどわかっていなかった。
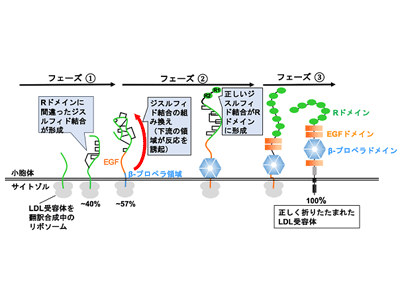
LDL受容体は複数のドメインからなる細胞表層タンパク質(膜タンパク質)で、ジスルフィド結合は、7個のRドメインと3個のEGFドメインの各々に3本ずつ存在する。LDL受容体は血液中のLDLを結合し、細胞内に取り込む。このタンパク質が正しい立体構造に折りたたまれないと、高コレステロール血症、ひいては脳梗塞、心筋梗塞などの疾患が引き起こされることが知られている。そこで今回、研究グループは、ジスルフィド結合によりLDL受容体が折りたたまれる仕組みを解明することを目的として研究を行った。
LDL受容体の立体構造は、下流ドメインの制御を受け迅速に形成
研究グループは、まず、リボソーム上で翻訳合成されつつ小胞体内で伸長するLDL受容体のポリペプチド鎖にジスルフィド結合が導入される過程を観察するための系を構築することに成功。この系を用いて解析を行った。結果、LDL受容体のポリペプチド鎖が全長の約 40%の長さにまで伸長し、先のRドメインが小胞体中に出現すると、天然構造にはない誤った組み合わせのシステイン間にジスルフィド結合が導入されることがわかった。さらに、LDL受容体が全長の約57%の長さにまで伸長し、下流に存在するβ-プロペラと呼ばれるドメインの一部が合成されると、これが引き金になって、先のRドメイン中に導入されていた非天然型のジスルフィド結合が正しい結合へと組み換えられることを発見した。
ジスルフィド結合の組み換え反応は、複数のドメインから構成されるタイプのさまざまな細胞表層タンパク質の立体構造形成において鍵となる反応ステップで、従来は、タンパク質の翻訳合成が終わった後、数十分の時間をかけてゆっくりと進行すると信じられてきた。しかし今回の研究から、この反応は、これまでに考えられていたよりも遥かに早い段階(タンパク質の翻訳合成中)において、精緻な制御のもと、進行しうることが初めて明らかになった。
タンパク質の立体構造形成の途上にある分子は変性しやすいことが知られている。よって、LDL受容体は正しい立体構造に早く到達することによって、自身の変性のリスクを低減させている可能性がある。また、複数のドメインからなる、他の多くの細胞表層タンパク質も同様に、翻訳合成反応の進行とともに、速やかに折りたたまれている可能性が考えられる。研究グループは、今回の研究で得られた知見について、「LDL受容体の立体構造形成上の問題によって高コレステロール血症、脳梗塞、心筋梗塞などの病気が引き起こされている場合には、その仕組みを理解するための基盤になると期待される」と、述べている。
▼関連リンク
・東北大学 プレスリリース






