PIK3CA変異ありの大腸がん細胞で、アスピリンとグルタミン代謝との関連を検討
関西医科大学は6月22日、大腸がん培養細胞を用いた網羅的遺伝子発現解析(RNA-seq)により、アスピリンがグルタミン代謝を活性化させるメカニズムを解明したと発表した。これは京都府立医科大学大学院医学研究科分子標的予防医学の渡邉元樹講師、朴将源氏(現:関西医科大学附属病院がんセンター助教)らの研究グループによるもの。研究成果は、科学雑誌「Cancers」に掲載されている。
画像はリリースより
抗血小板薬として幅広く利用されているアスピリンは、その抗腫瘍効果が近年注目されており、がん予防・治療を目的としたドラッグ・リポジショニングの最有力候補といわれている。しかし、消化性潰瘍や出血傾向など、アスピリンによる副作用は無視できず、アスピリンの抗腫瘍効果を事前に予測するバイオマーカーの探索や、アスピリンの抗腫瘍効果をより安全に、より効果的に高めるための併用治療薬の開発が精力的に進められている。
がんゲノム解析の進歩により、アスピリンの抗腫瘍効果とがんゲノムとの関係が明らかとなってきている。とりわけ、大腸がんの10~20%を占める「PIK3CA」遺伝子変異の大腸がんにおいて、アスピリンの効果が高いという臨床データが近年相次いで報告されているが、その詳細なメカニズムに関しては明らかではない。がん細胞は正常細胞と異なり、さまざまな代謝経路の異常が過剰な細胞増殖を支えていることが知られている。PIK3CA遺伝子変異がん細胞においても、アミノ酸代謝のひとつである、グルタミン代謝が活性化することから、研究グループは、「PIK3CA遺伝子変異によるグルタミン代謝の増進が、アスピリンの感受性に影響を与えているのではないか」との仮説を立て、詳しく調べた。
アスピリン<ATF4発現誘導<がん細胞内グルタミン代謝活性
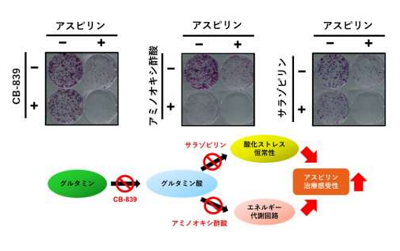
はじめに、アスピリンの効果予測因子として知られるPIK3CA遺伝子変異の有無や、細胞培養液中のグルタミンの有無が、アスピリンの細胞増殖抑制効果に影響を与えるかについて検証した。その結果、PIK3CA遺伝子変異をもつ大腸がん細胞は、培養液のグルタミンを除去することにより、アスピリンの感受性が低下することを発見した。
次に、培養液中のグルタミンを除去した場合に誘導される、アミノ酸代謝のマスターレギュレーターである転写因子ATF4が、アスピリン処理した場合にも発現誘導されることを分子生物学的手法により確認。これは、アスピリンががん細胞のグルタミン取り込みを促進している可能性を示している。そこで、アスピリン処理が遺伝子発現におよぼす影響をRNA-seqを用いて解析したところ、アミノ酸の細胞内への取り込みを司るトランスポータータンパク質に関連する遺伝子群の発現上昇を認めた。さらに、アスピリン処理により複数のグルタミン代謝関連酵素が発現上昇することを見出し、これまで知られていなかった「アスピリンがATF4の発現誘導を通じて、がん細胞内のグルタミン代謝を活性化させる」という新規知見を得た。
アスピリンとグルタミン代謝阻害薬の併用がより効果的な可能性
アスピリンを用いたがん予防・治療に応用するため、PIK3CA大腸がん細胞に対して、アスピリンとさまざまなグルタミン代謝阻害薬を、長期間(1週間)にわたり併用処理したところ、相乗的ながん細胞のコロニー形成抑制効果を認めた。これにより、アスピリンにより活性化されたグルタミン代謝が、酸化ストレスによる耐性や、エネルギー代謝回路の活性化を通じて、がん細胞の生存に重要であることが示唆されたとともに、アスピリンとグルタミン代謝阻害薬の併用療法が、アスピリン単剤治療と比べ、より効果的な治療選択肢となる可能性を示した。
今回の研究により、PIK3CA変異ありの大腸がんにおいて、グルタミン枯渇環境ではアスピリンの抗腫瘍効果が十分に発揮されないことが明らかになった。また、その分子メカニズムとしてアスピリンがグルタミン代謝を活性化することがわかった。さらには、アスピリンにより活性化されたグルタミン代謝を阻害することで、よりアスピリンの抗腫瘍効果を高められる可能性を示した。近年、がん遺伝子解析をもとにした「精密医療(プレシジョン・メディシン)」が注目されている。「今回の研究で、がんゲノムのみを標的とする医療は不十分で、環境(がん細胞の代謝環境)にも注目する重要性が明らかになった。本研究をさらに発展させることにより、アスピリンのがん予防・治療効果を最大限に発揮する治療方法の開発が期待され、ゲノムと代謝を標的とした新時代のがん精密医療の実現に貢献したい」と、研究グループは述べている。
▼関連リンク
・関西医科大学 プレスリリース






