腸管での異物認識に重要なM細胞、数を厳密に制御する仕組みとその役割は?
慶應義塾大学は1月14日、マウスの腸管に微生物や抗原の体内への取り込みを調整する仕組みがあることを発見したと発表した。この研究は、同大薬学部の木村俊介准教授(北海道大学大学院医学研究院 客員研究員)、中村有孝特任助教、長谷耕二教授を中心とする研究グループが、北海道大学と共同で行ったもの。研究成果は、国際学術誌「Nature Communications」電子版に掲載されている。
画像はリリースより
食物中には、栄養成分に加えてさまざまな異物が存在し、食事とともに腸に運ばれる。腸内には大量の微生物が存在し、腸内細菌叢を形成している。ヒトの体はこれらの異物や微生物と上手に共存していく必要があり、それに失敗すると体に悪影響が生じる。健康を保つためには免疫系が腸内環境を適切にコントロールする必要があるが、それには腸管の免疫系が作り出す分泌型IgA抗体が重要となる。分泌型IgA抗体は腸内の抗原に結合し、病原菌の排除や毒素の中和に働く。腸内の分泌型IgA抗体産生に、中心的な役割を果たすのがリンパ組織の「パイエル板」だ。
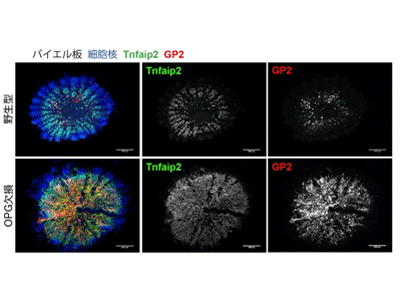
体内と腸管内腔は腸管上皮というシート状の構造によって隔離され、異物が入らないような構造を持つ。一方、パイエル板の上皮には物質の取り込みに特化した細胞である「M細胞」が存在している。抗原物質をM細胞が取り込み、上皮下へと運び、免疫細胞が情報を得ることが、抗原に対して親和性の高い抗体が産生されるために重要だ。M細胞の数は極端に少なく、さらに腸管内のごく限られた部位にしか存在していない。このことから、M細胞数の厳密な制御システムが存在していると想定されるが、その制御がどのように行われ、そして制御が失われたときに何が起こるかは不明だった。
独自の技術でM細胞の遺伝子発現パターンを解析し、OPG発現を発見
今回研究グループは、数が少なく解析が難しかったM細胞をマウス腸管から分離、濃縮する技術を独自に開発。回収したM細胞内のmRNA情報をRNAシークエンス解析(RNA-seq)により高精度に解析することに成功した。結果、Osteoprotegerin(OPG)をコードする遺伝子がM細胞で強く発現していることが示唆され、組織学解析から、腸管内でOPGを発現する細胞はM細胞であると結論づけられた。
OPGは骨を吸収する破骨細胞の分化を抑制する分子として報告があるが、腸管におけるOPGの生理的機能は不明だった。そこで、OPGを欠損したマウスのパイエル板を解析したところ、OPG欠損マウスではM細胞の数が顕著に増加していた。これにより、腸管のOPGはM細胞分化の抑制に働くことが明らかになった。
マウスの盲腸にはパイエル板とよく似た盲腸パッチ(Cecal Patch)が存在する。盲腸パッチでは成熟したM細胞が少なく、物質の取り込みも抑制されていることを研究グループは過去に発表したが、その原因を突き止めるまでには至っていなかった。今回、OPG欠損マウスの盲腸ではM細胞数が増加し、ほとんど無かった取り込みも顕著に増加していることが判明。これにより、M細胞におけるOPGの発現量が盲腸では高く、M細胞の成熟化をほぼ完全に抑え込んでいることが示唆された。
OPGによるM細胞数抑制で感染リスク低下、M細胞数増加では大腸炎抑制効果
体内への取り込みを促進するM細胞数の増加は、腸管上皮の物理的防御の低下を引き起こすと想定される。そこで研究グループは、M細胞から侵入する食中毒菌(サルモネラ菌)をマウスへと感染させた。その結果、予想どおり、OPG欠損マウスでは感染率、死亡率が増加した。一方で、実験的大腸炎を誘導した場合では、OPG欠損マウスにおいて大腸炎の症状が緩和することがわかった。
OPG欠損マウス腸管の免疫系を解析した結果、抗体産生に関与するB細胞の数が増加していた。実際にOPG欠損マウスでは、経口摂取させた抗原に対する抗体が多く産生され、腸粘膜における免疫の活性化を確認。さらに、腸内細菌に対する抗体量が腸管および、血中で増加していた。腸内細菌特異的抗体として主にIgA、IgG3が増加していたことから、これらの抗体量の増加が大腸炎の症状緩和に重要ではないかと考えられた。そこで、IgA陽性細胞、IgG3陽性細胞を免疫不全マウスへと投与したところ、大腸炎抑制効果が認められたことから、その仮説が正しいことが確認された。大腸炎において腸管上皮のバリアが壊れ、内容物が血中へと漏れ出すと症状の悪化を招く。OPG欠損マウスでのIgA、IgG3抗体の増加は糞便中だけではなく、血中でも認められたことから、血中に腸内細菌特異的抗体が存在していることが、大腸炎の症状緩和に効果があったと研究グループは考察している。
▼関連リンク
・慶應義塾大学 プレスリリース






