認知症の半数以上を占めるにも関わらず、治療法が開発されていないアルツハイマー病
産業技術総合研究所(産総研)は11月22日、アルツハイマー病(AD)の原因因子の1つであるアミロイドβタンパク質(Aβ)のオリゴマーのみを神経細胞内に発現し、発症初期の病態を示す新規ADモデルマウスを開発したことを発表した。この研究は、同バイオメディカル研究部門脳遺伝子研究グループ 落石知世主任研究員、戸井基道研究グループ付、海老原達彦研究グループ付、細胞分子機能研究グループ 清末和之研究グループ長が、植草学園植草学園大学 保健医療学部 角正美講師、順天堂大学医学部 脳神経内科 志村秀樹准教授らと共同で行ったもの。研究成果は、「Scientific Reports」電子版に掲載されている。
画像はリリースより
超高齢社会を背景に、世界的に認知症患者が急速に増加し、大きな社会問題となっている。認知症の発症や進行を少しでも遅らせることは増大する社会的負担の軽減につながるため、予防・創薬・早期診断法の開発が喫緊の課題となっている。特にADは、認知症の中でも半数以上を占めるにも関わらず発症メカニズムは解明されておらず、有効な治療法も開発されていない。
ADはこれまで、神経細胞外でのAβの凝集・蓄積が引き金となって発症すると考えられてきた。その病態解明のためにAβの前駆体であるアミロイド前駆体タンパク質(APP)を過剰に発現させたさまざまなトランスジェニックマウスが作製されてきたが、APPからはAβ以外のペプチドも過剰発現し、それらによる二次的な作用も考慮しなければならず、ADのモデルとして適切とは言えなかった。一方、最近では、老人斑が蓄積する以前から、Aβオリゴマーが神経細胞内に蓄積し、発症に関与するという説が有力とされている。しかし、これまでのモデルマウスでは、オリゴマーの作用と神経細胞外の凝集体の作用との区別が困難で、オリゴマーの毒性解析に適したモデルマウスは開発されていなかった。
従来のモデルマウスと比較し、認知機能障害が早期に発現
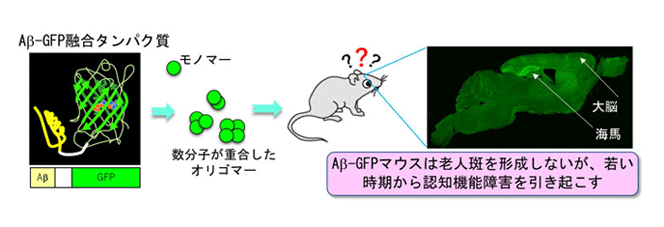
そこで研究グループは、Aβ-GFPをマウス個体に発現させ、生体内でAβオリゴマーの動体や局在部位を直接可視化し、発症初期の神経細胞内の微細な変化を捉え、毒性との因果関係や治療薬の候補物質の効果を解析できる新たなADモデルマウスの開発に取り組んだ。
今回開発したAβ-GFPを発現するトランスジェニックマウス(Aβ-GFPマウス)は、APPではなく、毒性の強いAβ1-42のみにGFPを融合させたタンパク質を発現するため、APPの過剰発現によって産生されるAβ以外の生理活性ペプチドの作用を考慮する必要がない。また、細胞外に分泌されるシグナル配列を持たないため、細胞内だけにAβオリゴマーが蓄積し、脳内では海馬・大脳皮質などの神経細胞に強く発現する。実際に、Aβ-GFPマウスの神経細胞には、GFPのみを発現した対照マウスと比較して、Aβ-GFPの小さな粒が無数に見え、細胞内でAβがオリゴマーを形成していることが示された。
ADは、Aβを主成分とする老人斑の神経細胞周囲への沈着と、過剰にリン酸化されたタウタンパク質が神経細胞内に沈着する神経原線維変化と、脳の萎縮を主な病理学的特徴とする。Aβ-GFPマウスは、オリゴマーだけを形成し細胞外に分泌されないので、老人斑は形成せず脳萎縮も起こらないが、加齢とともにタウタンパク質のリン酸化が亢進した。
記憶や学習に重要な脳の領域「海馬」で、シナプスの可塑性を評価したところ、刺激に応じてシナプス伝達の増強が長く続く長期増強(LTP)が、このモデルマウスでは野生型と比較して有意に低下していた。この現象は、細胞レベルでの記憶形成に関わる現象として考えられており、機能的に記憶形成に異常があることを示している。また、樹状突起のスパインの数や、一部のシナプス構成タンパク質の量も減少した。これらの現象は、AD患者の死後脳から抽出したAβオリゴマーや合成されたオリゴマーを用いたこれまでの報告と同様の結果であり、Aβ-GFPがヒトのAβオリゴマー同様の強い毒性を持つことを示している。
さらに、新奇物体認識テストによる行動学的解析行った結果、見本期1時間後のテストでは、生後2~3か月齢の若い個体と18か月齢の老齢個体の両者で、新奇物体に対する探索行動はAβ-GFPマウスで有意に減少した。また、認知機能障害が起こっていると判断されるチャンスパフォーマンスと比較したところ、野生型では、若い個体でも老齢個体でも、全てのテストで選好率がチャンスパフォーマンスより有意に高く、記憶障害は見られなかった。一方、Aβ-GFPマウスでは、若い個体の1時間後のテスト以外では、選好率とチャンスパフォーマンスには有意差が認められなかった。これらは、Aβ-GFPマウスでは、生後2~3か月齢の若い時期から認知機能が低下しており、それが加齢とともに悪化することを示している。従来のモデルマウスでは認知機能の低下は早くても6か月齢程度で初めて現れることから、Aβ-GFPマウスはきわめて若い時期から認知機能障害を示している。
Aβ-GFPマウスが発症メカニズムの解明や、創薬候補物質の探索に利用できる可能性
これらのことから、Aβ-GFPマウスは神経細胞の周囲にAβの凝集体が沈着する以前に、神経細胞内で発現するAβオリゴマーの毒性の解析にきわめて有効であり、認知症発症初期のシナプス部で起こる変化を捉え、発症のメカニズムの解明や、予防・病気の進行を抑える創薬候補物質の探索に利用できると思われる。
研究グループは、「今後はAβ-GFPマウスにADの予防薬や治療薬の候補物質を投与して、認知機能の改善に効果のある創薬候補物質の探索を行う。また、認知機能を改善するとされる運動などによる効果をこのマウスで検証し、生体の持つ認知機能向上のメカニズムの解明や、AD予防に関する研究を進める」と、述べている。
▼関連リンク
・産業技術総合研究所 研究成果






