より生体に近い腫瘍組織モデルを作りたい
京都大学は11月12日、生体内の固形がんを模したモデル内に血管を誘導し、血流を介した栄養供給が、腫瘍モデルの成長、薬剤評価に与える影響を評価するシステムを開発したと発表した。この研究は、同大大学院工学研究科の横川隆司教授、東北大学学際科学フロンティア研究所の梨本裕司助教らの研究グループによるもの。研究成果は、国際学術誌 「Biomaterials」のオンライン速報版に掲載されている。
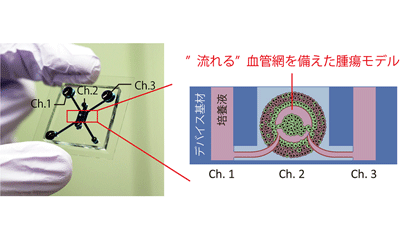
画像はリリースより
薬剤開発においては、培養皿での細胞に対する薬剤投与から動物実験を経て臨床試験に至るまで、多くの時間と資金が必要となる。この薬剤開発の効率を向上させるため、生体内の腫瘍組織を模倣した腫瘍モデルの構築が求められている。細胞を凝集させ、立体的に培養するスフェロイドモデルは、従来の培養皿を用いた培養手法に比べ、形状や内部の化学物質濃度(酸素など)が生体内の腫瘍組織に近く、薬剤スクリーニングツールとして期待されている。しかし、従来のスフェロイドモデルは、腫瘍微小環境を構築する重要な要素である血管、および血管内の流れを再現できていなかった。今回研究グループは、同グループが過去に報告した「流れる血管を組織モデルに導入するためのマイクロ流体デバイス」をベースとして、流れる血管を備えた腫瘍モデルの構築に取り組んだ。
腫瘍組織モデル内に「流れる」血管を構築することに成功
最初に、腫瘍細胞のみから構成されるスフェロイドをマイクロ流体デバイス内で培養し、血管誘導を試みたが、腫瘍組織モデル内に十分な血管を呼びこむことができなかった。次に、腫瘍細胞を繊維芽細胞、血管内皮細胞と混合したスフェロイドを作成し、血管誘導を試みたところ、ある混合割合で、腫瘍組織モデル内に「流れる」血管を構築できることがわかった。そこで、構築した血管網が腫瘍モデルに与える影響を調べるため、構築した血管を介して連続的に培養液を供給し、腫瘍組織が成長する様子を評価した。その結果、血管を経て栄養供給を行った腫瘍モデルは、流れる血管を備えない腫瘍モデルと比べて腫瘍の面積、増殖活性が有意に高くなり、一方で、細胞死が起こる面積は有意に小さくなることを確認した。これは、血管を介した栄養供給が腫瘍の増殖に有利に働いていることを意味しているという。
さらに、構築したモデルを用い、流れのある条件下で薬剤投与(抗がん剤:パクリタキセル)を行ったところ、高濃度(50 ng/mL)の薬剤投与では腫瘍面積の減少が観察できたが、低濃度の投与(5 ng/mL)では腫瘍面積の減少は観察されなかった。一方で、静止条件での薬剤投与では、低濃度であっても腫瘍面積の減少が観察された。これは、低濃度領域では流れによる増殖活性の促進の効果が、抗がん剤による増殖抑制の効果より強く現れたためと考えられる。
腫瘍組織内の血管は、腫瘍微小環境を構築する重要な要素であり、治療の対象としても期待されている。今回開発した微小流体デバイスを用いれば、腫瘍組織の増殖、腫瘍への経血管的な薬剤投与の効果、血管と腫瘍細胞間の生化学的・力学的な相互作用などを顕微鏡下において実時間で観察することができる。血管を通る「流れ」を含む腫瘍微小環境を再現したオンチップ腫瘍組織モデルは報告されておらず、薬剤開発において「流れ」の効果まで含めて評価するスクリーニングツールとしての利用も期待できると、研究グループは述べている。
▼関連リンク
・京都大学 研究成果



