大きな病原体をどうやって取り込んでいるのか
奈良先端科学技術大学院大学と九州大学は10月21日、マクロファージなどの免疫細胞が異物を取り込み消化する際にできるカップ型の構造体である「ファゴサイトーシス(食作用)カップ」の形成機構の一端を明らかにしたと発表した。この研究は、奈良先端科学技術大学院大学先端科学技術研究科 バイオサイエンス領域の末次志郎教授の研究グループが、九州大学生体防御医学研究所の嶋田睦准教授、東京工業大学、大阪大学、理化学研究所などと共同で行ったもの。この研究成果は、「Nature Communications」オンライン版に掲載されている。
画像はリリースより
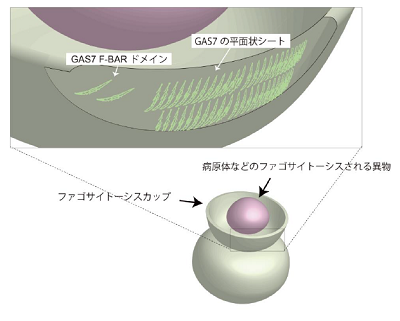
生体にとって異物と認識される細菌やウイルスといった病原体などが、マクロファージなどの免疫細胞により取り込まれ細胞内で分解される過程は「ファゴサイトーシス」と呼ばれ、重要な防御機構とされる。その際、細胞膜が突出し病原体や異物を包み込み、その後細胞内に取り込む。この構造は、「ファゴサイトーシスカップ」と呼ばれる。細胞外からの物質取り込みは、多くの場合、直径100nm程度の比較的小さな細胞膜の構造形成を通じて行われる。ところが、病原体などは通常輸送される微少領域よりも格段に大きく、どのように病原体や異物を取り込むための生体膜構造が形成されるか不明だった。
これまで、ファゴサイトーシスカップの形成機構は、細胞が移動するときに見られる移動先端の「ラメリポディア」(葉状仮足)などの生体膜構造との類似性が指摘されてきた。また、直径100nm程度の比較的小さな細胞膜の構造による物質の取り込みに関わるタンパク質とは異なる作動機構を持つタンパク質が関与することが推定されていた。末次教授らは、「BAR(Bin-Amphiphysin-Rvs)ドメイン」と呼ばれるタンパク質ドメインの研究を行ってきた。BARドメインは、脂質膜上でタンパク質集合を起こすことにより、ブロックのように脂質膜の形状を形成するドメインであることがわかっていたが、ファゴサイトーシスカップにおいて機能する BARドメインはあまり知られていなかった。
タンパク質ドメイン「GAS7」が結集・形成、免疫反応の抑制など医療応用に期待
研究グループは今回、ヒトがもつ73種のBARドメインのうち、ラメリポディアなどに局在することが報告されながら構造が未解明であるものを探し、GAS7のF-BARというBARドメインに注目。同ドメインを解析した結果、他のタンパク質のF-BARドメインと比較的似通った構造であることを見出した。さらに、GAS7がどのようにブロックのように集まりファゴサイトーシスカップにおいて機能するかについて調べたところ、細胞の比較的大きな部分を占めるファゴサイトーシスカップの形成に適した平面状の集合をすることがわかった。また、研究グループは、この集合が、試験管内で再構成でき、同様の集合が実際のファゴサイトーシスカップにおいて見られることを、超解像イメージングをはじめ、数理モデル解析や生化学・ 細胞生物学的解析により詳細に明らかにした。
ファゴサイトーシスは、免疫などにおける防御反応として実際の反応を実行する過程と捉えることができる。また、大きな細胞の形態変化を伴うことから、純粋に科学的な興味をかきたてるものでもあるという。今回、ファゴサイトーシスカップにおいて、精密な分子集合が機能することが明らかになり、この知見を応用した、例えば過剰な食作用を抑制することで免疫反応を抑制するような、新たな戦略が考えられる可能性があると研究グループは述べている。
▼関連リンク
・奈良先端科学技術大学院大学 プレスリリース






