発症機序解明のため、IPFを正確に模倣する動物モデルを開発
徳島大学は10月11日、家族性特発性肺線維症(IPF)のゲノム解析から、その原因遺伝子としてSFTPA1を同定し、SFTPA1の変異によりII 型肺胞上皮細胞(AEII細胞)のネクロプトーシスが亢進することが病態の起点になっていることを解明したと発表した。この研究は、同大学大学院医歯薬学研究部(医学系)の安友康二教授らの研究グループによるもの。研究成果は、「The Journal of Experimental Medicine」に掲載されている。
画像はリリースより
IPFは、多くの場合には50歳以上で発症し、喫煙との関連性が高いことが知られている。発症率としては10万人あたり10~20人とされているが、未発症で診断がついていない早期病変の患者を含めるとさらに頻度は高いと考えられている。IPFは診断後早期に死亡することが多いことから、その病態解明と治療薬開発が求められているが、未だ死亡率を劇的に改善させる薬剤は開発されていないのが現状。IPFの大半は孤発性だが、まれに家族性IPFもあることが知られている。これまで、家族性IPF患者のゲノム解析では、TERCやTERTなどのテロメラーゼ関連遺伝子あるいはサーファクタントプロテインC遺伝子などが報告されてきたが、家族性IPFの70%以上は原因遺伝子が不明だった。
これまで、IPFモデルマウスとして、ブレオマイシンを全身あるいは気管内に投与するモデルが世界中で用いられてきた。しかし、ブレオマイシンを投与するような薬剤誘導性のモデルは、ヒトのIPFを正確に模倣しているとはいえず、IPFの自然発症モデルが求められていた。今回、研究グループは日本における家族性IPFの家系例を調査し、IPFの一家系を見出した。その家系例のゲノム解析を実施することで、原因遺伝子としてSFTPA1を同定し、さらにSFTPA1の変異を持ちかつ病態を正確に模倣できるモデルマウスを樹立することで、その後の発症機序の解析を行った。
原因遺伝子SFTPA1を同定、AEII細胞のネクロプトーシスが病気の起点と判明
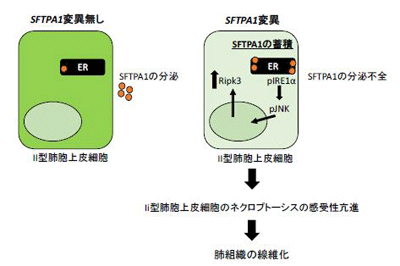
研究グループはまず、近親婚歴を有する家族性IPFの家系例のゲノムサンプルを用いて、連鎖解析、ホモ接合体マッピングとエクソーム解析を行い、その原因となる変異としてSFTPA1のミスセンス変異を同定。SFTPA1のミスセンス変異によってSFTPA1の分泌が障害されていることが判明した。次に、SFTPA1のミスセンス変異がどのようにIPFの発症に関与するかを知るために、マウスのSftpa1にもヒトと同じ変異を導入 (Sftpa1-KIマウス)。Sftpa1-KIマウスでは、約40週齢頃からマウスが肺線維症で死亡し始めることが観察され、ヒト疾患を正確に模倣していると考えられた。また、Sftpa1-KIマウスにインフルエンザウイルスを感染させると肺線維症を急性増悪することも観察され、肺線維症の発症機序を解析するために非常に有用なマウスモデルであると考えられた。
Sftpa1-KIマウスの肺組織を検証した結果、AEII細胞の細胞死が亢進していることが判明。どのタイプの細胞死が関与しているかを検証した結果、ネクロプトーシスがその細胞死に関与していることがわかった。実際に、Sftpa1-KIマウスにおいて、ネクロプトーシスの制御分子であるMlklを欠損させると、肺線維症の発症が抑制されることが観察された。さらに、ネクロプトーシスの亢進の機序について解析したところ、IRE1α経路とそれに続くJNKが活性化した結果RIPK3の発現が亢進していることを発見。RIPK3がAEII細胞で過剰に発現することによってAEII細胞のネクロプトーシスへの感受性が亢進していることも明らかになり、それがSFTPA1変異によるIPFの起点であることが解明された。
今回の研究により、IPFの新たな原因遺伝子が明らかになり、未解明であったIPFの発症機序としてネクロプトーシスの亢進が明らかになった。またその上流経路として、ER(小胞体)ストレスの亢進が寄与していることも解明された。これらの成果から、それらの分子経路がIPFの新たな治療標的になり得ることが考えられる。また、今回の研究からネクロプトーシスが病気の起点になっていることが解明された。一方で、その後にどのような経路を介してIPFが進むかについては、明らかになっていない。同研究グループは今後、今回の研究で開発したSftpa1-KIマウスを用いることで、ネクロプトーシス以後の経路を明らかにし、線維化を誘導する新たな治療標的を見出す研究に取り組んでいきたいとしている。
▼関連リンク
・徳島大学 報道発表






