α-シヌクレインのユビキチン化と凝集体形成のメカニズムを研究
新潟大学は9月10日、パーキンソン病の病原性タンパク質であるα-シヌクレインのユビキチン化と凝集体形成を抑制する分子「G3BP1タンパク質」を同定したと発表した。この研究は、同大学大学院医歯学総合研究科ウイルス学分野のAnisimov Sergei大学院生、髙橋雅彦准教授、藤井雅寛教授らの研究グ ループによるもの。研究成果は「Scientific Reports」オンライン版にて公開された。
画像はリリースより
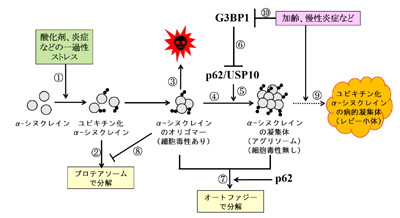
パーキンソン病は、黒質、線条体などのドーパミン神経細胞の変性と脱落を主体とする進行性の神経変性疾患。家族性および弧発性パーキンソン病の原因タンパク質として、α-シヌクレインタンパク質が知られている。神経細胞が、酸化剤、炎症などのストレスに曝されると、α-シヌクレインタンパク質がユビキチン化され、オリゴマー(多量体)を形成する。このオリゴマーが神経細胞に毒性を示し、神経細胞を死滅させる。
また、パーキンソン病の脳病変には、ユビキチン化α-シヌクレインの凝集体(レビー小体)が観察される。このレビー小体はパーキンソン病の特徴のひとつだが、α-シヌクレインタンパク質のユビキチン化と凝集体形成をコントロールするメカニズムについて、多くは明らかになっていない。
G3BP1、ユビキチン化α-シヌクレインの凝集体形成を抑制
研究グループは、G3BP1タンパク質がα-シヌクレインのユビキチン化と凝集体形成を抑制していることを発見。G3BP1による抑制に、p62タンパク質とUSP10タンパク質が関与していることがわかった。p62とUSP10は、すでにα-シヌクレインのタンパク質分解、凝集体形成および細胞毒性を制御することが報告されている。また、G3BP1は、α-シヌクレイン以外の多くのタンパク質のユビキチン化と凝集体形成を抑制していることが判明した。
これらの結果は、G3BP1がタンパク質のユビキチン化およびユビキチン化タンパク質の凝集体形成を制御する主要因子であることを示している。ユビキチン化タンパク質の異常な蓄積は、さまざまな神経変性疾患の発症に関与することから、G3BP1が複数の神経変性疾患の発症を抑制していることが示唆された。研究グループは、G3BP1を標的とした治療薬について解析を進めているとしている。
▼関連リンク
・新潟大学 プレスリリース






