技術的なジレンマで仮説レベルに留まっていた「骨組織形成」の初期過程
大阪大学は7月4日、生きたままの骨芽細胞が基質小胞を細胞内で形成・分泌する過程を、新しい顕微鏡技術を用いてナノレベルの解像度で観察し、細胞内で形成された基質小胞が、細胞内の不要物を分解するリソソームを使って運搬され、細胞外に分泌されることを世界で初めて明らかにしたと発表した。この研究は、同大学院歯学研究科の岩山智明助教、村上伸也教授らの研究グループが、産業技術総合研究所(産総研)バイオメディカル研究部門の岡田知子総括研究主幹、小椋俊彦上級主任研究員、およびライオン株式会社と共同で行ったもの。研究成果は、「Science Advances」オンライン版に掲載されている。
画像はリリースより
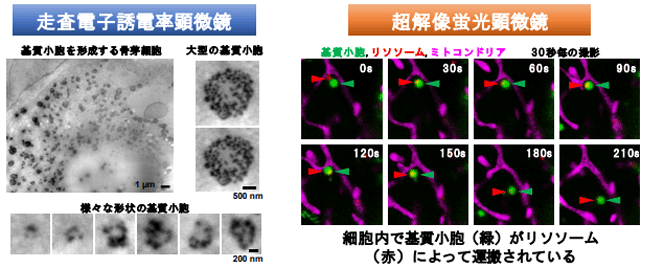
骨組織が形成される初期過程においては、骨芽細胞から30~300nmの基質小胞が細胞外へと分泌されることが必須と考えられており、その仕組みの解明が求められてきた。しかし、nmオーダー(10億分の1メートル)の微小物質を観察できる電子顕微鏡では、試料を化学固定した上で真空中に置くため、生細胞を直接観察することが不可能。また、生細胞を直接観察できる光学顕微鏡では、微小物質の観察が困難という技術的なジレンマが存在しているため、詳細な解析は進展しておらず、骨組織形成の初期過程に関する記載は、専門書においても古くからの仮説レベルに留まっていた。
走査電子誘電率顕微鏡と超解像蛍光顕微鏡の併用で、基質小胞の可視化に初めて成功
研究グループは、これらの問題を克服し、培養細胞を生きたまま高解像度で観察するため、産総研の小椋上級主任研究員が開発した独自の走査電子誘電率顕微鏡(SE-ADM)と、超解像蛍光顕微鏡を併用。その結果、生細胞中の基質小胞の可視化を実現し、さらに、基質小胞が細胞内に蓄積し、リソソームによって運搬され、細胞外に分泌されていることが明らかとなった。
今回の研究成果により、骨や歯といった硬組織形成の基本的なメカニズムに関する理解が深まり、骨粗しょう症や歯周病などの硬組織疾患の病態解明や、治療法の開発につながることが期待される。研究グループは、「今回観察に用いたSE-ADMは培養細胞のみならず、さまざまな微小物質を溶液中で直接観察することが可能であり、今後もさまざまな分野での応用が期待される」と、述べている。
▼関連リンク
・大阪大学 研究情報






