明らかにされていなかった「皮膚バリア構造」について研究
理化学研究所(理研)は6月19日、ヒトの正常皮膚の表皮内において、神経線維がタイトジャンクション(TJ)と呼ばれる皮膚バリア構造の内側に、常に保持されていることを明らかにしたと発表した。この研究は、同生命医科学研究センター組織動態研究チームの岡田峰陽チームリーダー、髙橋苑子リサーチアソシエイトと皮膚恒常性研究チームの天谷雅行チームリーダー、久保亮治客員研究員らの共同研究グループによるもの。研究成果は「Scientific Reports」に掲載されている。
画像はリリースより
皮膚バリアは水分などの体内物質を保持し、外来物の侵入を阻止するという、体の恒常性になくてはならない役割を果たしている。皮膚構造は外側の表皮と内側の真皮、および皮下組織に分けられるが、皮膚バリア機能を持つ構造は2つあり、1つは、1番外側にある死んだ角化細胞からなる角質層で、もう1つは、そのすぐ内側で死ぬ少し前の角化細胞が形成する「タイトジャンクション(TJ)」だ。
皮膚バリア機能は、さまざまな原因で減弱するが、遺伝的要因や環境の影響による天然保湿成分の減少も、代表的な原因のひとつ。乾燥皮膚では、皮膚バリアが減弱して痒みを引き起こす。それに引っかきも加わることで、さらに皮膚バリアが減弱すると、さまざまな外来物の侵入が継続的に起こり、それがアトピー性皮膚炎の原因になると考えられている。一方、もう1つのバリア構造であるTJについても、その減弱がアトピー性皮膚炎発症に寄与すると提唱されていた。近年、進行したアトピー性皮膚炎において、炎症細胞が産生するインターロイキン-4(IL-4)やIL-31といったサイトカインが、感覚神経を直接活性化することで痒みを引き起こすことが明らかになってきており、治療標的として実用化されている。しかし、発症前後の時期の皮膚バリアの減弱自体が、どのように痒みを引き起こすのかは不明だった。
「皮膚バリアの減弱で外からの刺激が入りやすくなり、皮膚感覚が過敏になるから」という仮説はあるものの、皮膚バリア構造と表皮内の感覚神経の位置関係についてさえ、ほとんど明らかにされていない。
神経剪定が、皮膚感覚の恒常性維持に関わることが明らかに
そこで、研究グループは、表皮のTJバリア構造と神経の3次元イメージング解析を試みた。
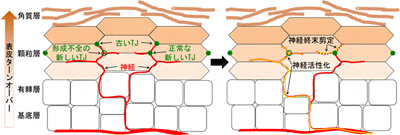
まず、ヒトの皮膚検体を切片を切らずにそのまま蛍光ラベルした抗体で染色し、表皮TJと神経の位置関係をレーザー蛍光顕微鏡により3次元的に解析した結果、ヒト正常皮膚検体では、神経線維は表皮TJのすぐ内側まで伸びていることが明らかになった。TJに内側から接触しているように見える神経線維が数多くあったが、TJに貫入して外側に突き出ている神経線維はほとんど見つからなかった。一方、アトピー性皮膚炎の病変部検体では、生化学的解析や切片染色による過去の報告と同様に、表皮TJが全く観察できないほど減弱していた。同様に、臨床上は非病変部とされる、症状が軽く肉眼では病変を確認し難い部位の検体でも、TJ構造が非常に減弱している部分があることが確認できた。
次に、アトピー性皮膚炎のモデルマウス(Spadeマウス)を用いて、発症時期の表皮でバリアと神経の観察を行った。このマウスの皮膚を、染色してイメージング解析した結果、発症直前の時期になると、角質層に加え、顆粒層TJのバリアにも異常が起こることが判明。症状が進行した表皮とは異なり、TJの構成タンパク質の集積は確認できたが、通常直線的なTJが曲線的になり、ゆがんでいる場所が見られた。このような症状は、野生型マウスや6週齢より若いSpadeマウスではほとんど見られず、ヒトの正常皮膚と同様に、神経はTJの内側に維持されていた。
さらに、感覚神経特異的に蛍光タンパク質を発現する遺伝子改変マウスを用い、生体内の表皮神経のライブ観察を試みた。その結果、古いTJバリアのすぐ内側に神経があり、そこに新しいTJバリアが形成されると、その交点で神経線維が切れ、そこから末端部分の線維が断片化・消失していることを発見。発症時期のSpadeマウスでは、神経のあるところに新しいTJが形成されても速やかに剪定されず、数時間以上もTJに貫入している神経線維も観察された。
このような状況下での神経活動を調べるため、異常なCa2+濃度上昇を担う分子と、その痒みへの寄与を調べるために、表皮の感覚神経に強く発現するイオンチャネルの遺伝子を探索し、痒みへの関与も示唆されているTRPA1というイオンチャネルに着目。そして、TRPA1阻害剤を皮膚に塗布すると、すでに痒みが出始めているSpadeマウスの表皮神経の、異常なCa2+濃度上昇が抑制され、さらに痒み自体も抑えられることがわかった。さらに、SpadeマウスにおいてTRPA1の遺伝子を欠損させると、掻痒皮膚炎が著しく減弱した。以上の結果から、TJバリアの減弱により感覚神経終末の剪定に異常をきたし、神経のTJバリアへの貫入や外側への突出が起こり、そこを起点に神経の異常な活性化が起こり、これが痒みの誘導に寄与している可能性が示された。
今回の研究成果により、表皮角化細胞と神経の相互作用による神経剪定が、皮膚感覚の恒常性維持に関わるという、新しい学説が提唱されたといえる。研究グループは、「この相互作用に関わる分子が明らかになれば、痒みなどの感覚を人為的に制御するための新たなターゲットとなる可能性がある。また、今後、さまざまなTRPA1阻害剤について、ヒトに対する有効性や安全性の研究が進めば、皮膚バリア機能異常による痒みを抑制する、新たな薬剤が生み出される可能性がある」と、述べている。
▼関連リンク
・理化学研究所 プレスリリース




