細胞死「ネクロプトーシス」は、周囲に強い炎症を誘導
東邦大学は5月27日、新たに開発した遺伝子改変マウスを用いて、ネクロプトーシスと呼ばれる新しいタイプの細胞死が、胎児期の小腸上皮細胞で生じることにより、重篤な小腸炎を発症することを明らかにしたと発表した。この研究は、同大学中野裕康教授の研究グループが、兵庫医科大学の大村谷昌樹主任教授、順天堂大学の内山安男特任教授、名古屋大学の木山博資教授、熊本大学の荒木喜美教授らと共同で行ったもの。研究成果は、米国の科学誌「iScience」に5月24日付で掲載された。
画像はリリースより
ヒトの体を正常に保つためには、一部の細胞が適切に死ぬことが重要だが、細胞死が過剰に起こるとさまざまな病気を発症すると考えられている。計画的細胞死では「アポトーシス」がよく知られているが、近年その他の細胞死の存在も明らかになってきている。ネクロプトーシスと呼ばれる新しいタイプの細胞死は、制御された細胞死だが、細胞膜が早期に破裂して死ぬことから、細胞から放出される物質によって周囲に強い炎症を引き起こすと考えられている。ネクロプトーシスは心筋梗塞や脳梗塞、またウイルス感染細胞の排除などに関与していることが示唆されているが、生体においてネクロプトーシスが生じた後にどのような応答が誘導されるかは十分に解明されていなかった。
ネクロプトーシスがアポトーシス誘導の引き金となっていた
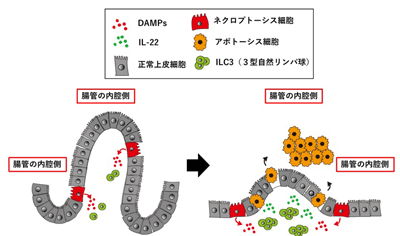
今回研究グループは、ネクロプトーシスを誘導する遺伝子「cFLIPs」を過剰に発現するマウスを開発。このマウスを用いて、ネクロプトーシス後の生体応答を個体レベルで解析した。その結果、cFLIPs過剰発現マウスの一部は子宮内で死亡することが判明。組織学的な解析では、全身の臓器にcFLIPsが発現しているにも関わらず、小腸でのみ重篤な炎症が認められた。小腸では、小腸上皮細胞の脱落と微絨毛の短小化が認められ、壊死性腸炎を発症していた。小腸上皮細胞においては予想通り一部の細胞にネクロプトーシスが誘導されていた一方で、大量の小腸上皮細胞がアポトーシスに陥り、腸管の中に脱落していることがわかった。さらに詳細な解析から、ネクロプトーシス細胞から炎症誘導物質(DAMPsと総称)が放出され、それに応答して3型自然リンパ球(ILC3)と呼ばれる特殊なリンパ球が小腸に集まり、さらに活性化され、その細胞の産生するサイトカインの1種であるIL-22の発現上昇が認められた。
小腸炎の発症のメカニズムを明らかにするために、ILC3やIL-22を除去したところ、アポトーシス細胞の出現をブロックしたものの、ネクロプトーシス細胞の出現は抑制しなかった。以上の結果により、「ネクロプトーシスになった小腸上皮細胞がILC3を活性化し、活性化されたILC3がIL-22を産生して、小腸上皮細胞にアポトーシスを誘導することで小腸炎が発症」、というネクロプトーシスに続く反応が胎児の小腸で起こっていることが初めて明らかとなった。
今回はcFLIPsを過剰発現するモデルでの解析だったが、胎児期の未熟な環境において虚血などが原因でネクロプトーシスが小腸上皮細胞に誘導される可能性も十分に考えられるという。一方でヒト新生児、特に未熟児が時に壊死性腸炎と呼ばれる重篤な病気を発症することが知られており、その原因として腸管への血流不足による低酸素状態などが考えられているが、十分に解明されていない。「今回作成したマウス胎児の小腸炎の組織像は、ヒト新生児に生じる壊死性腸炎に類似していることから、今回の研究の成果がヒト新生児の壊死性腸炎の原因の解明や、新たな治療法の開発につながる可能性が示された」と、研究グループは述べている。
▼関連リンク
・東邦大学 プレスリリース






