HCVのIRESはどのようにして翻訳効率を上げているのか
理化学研究所は5月14日、細胞に感染したC型肝炎ウイルス(HCV)がヒトの翻訳装置を乗っ取る新しい仕組みを発見したと発表した。この研究は、理研生命機能科学研究センター翻訳構造解析研究チームの伊藤拓宏チームリーダー、岩崎わかな専任研究員、タンパク質機能・構造研究チームの横山武司研究員、兵庫県立大学大学院工学研究科の今高寛晃教授、町田幸大助教、大阪大学蛋白質研究所の多田隈尚史助教らの共同研究グループによるもの。研究成果は、米国の科学雑誌「Molecular Cell」のオンライン版に5月9日付で公開された。
画像はリリースより
ウイルスは自分のみでは増殖することができず、宿主細胞を利用して自己複製を行う。肝がんにつながるC型肝炎を引き起こすHCVは、1本鎖RNAをゲノムに持つ。HCVは、感染した細胞内で自身のRNAを宿主の翻訳装置であるリボソームに読み取らせ、ウイルス増殖に必要な多数のタンパク質を効率良く合成する。ウイルスタンパク質の効率良い合成には、HCVのRNA配列に存在する「IRES」と呼ばれる領域が寄与していることはわかっていたが、IRESがどのように翻訳効率を向上させているかは未解明だった。
ヒトmRNAの翻訳が終わるのを待ち構え、その後にリボソームを「乗っ取る」
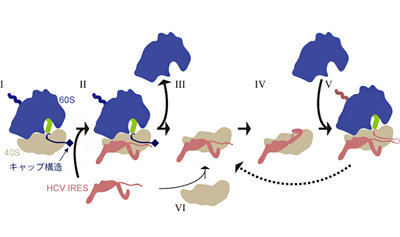
真核生物のリボソームは、40Sと60Sの大小2つのサブユニットから構成されている。真核生物のmRNAの末端には「キャップ」という構造が付加されており、ここに翻訳開始に関わるタンパク質群と、40Sサブユニット、60Sサブユニットが集まる。こうして、60Sサブユニットと40Sサブユニットに挟まれた形で、mRNA上の翻訳開始点から翻訳反応が始まる。
今回、研究グループはまず、HCVのIRESがどのような状態のリボソームに結合しているかを解析した。その結果、従来から唱えられていた通り、HCVのIRESは40Sサブユニットに結合していたが、加えて、既に他のmRNAを翻訳中のリボソームにも結合していることがわかった。そこで、その状態を詳しく調べるために、通常のヒト細胞の中で起こっているのと同じように、キャップ構造を持つmRNAと翻訳中のリボソームを試験管内に準備し、そこにHCVのIRESを加えた試料をクライオ電子顕微鏡で観察した。するとIRESが、進行中のmRNAの翻訳反応を邪魔することなく、40Sサブユニットに結合している構造を捉えることに成功した。さらに、蛍光顕微鏡を用いた1分子観察からも、IRESが確かに翻訳反応中のリボソームに結合していることを確認。これらの結果から、IRESは40Sサブユニットに結合しながら、宿主のmRNAの翻訳反応が終結するのを待ち構え、その後にリボソームを「乗っ取る」と考えられた。
新たな抗ウイルス薬の開発などに期待
また、HCVゲノムを翻訳中のリボソームに対しても、IRESはリボソームに結合し続けられるのかどうかを確かめるために、IRESに依存して翻訳を開始した場合についても試験管内で試料を調製し、クライオ電子顕微鏡で観察した。結果、予想通りIRESが、翻訳反応中のリボソームの40Sサブユニットに結合していることがわかった。
さらに、生化学的な実験により、HCVゲノム自身の、IRESに依存した翻訳の開始は、キャップ構造を持つmRNAを翻訳中のリボソームを用いた方が、翻訳反応に使われていない空のリボソームを用いるよりも、迅速に進むことが明らかになった。この結果とクライオ電子顕微鏡による観察結果を併せると、従来の「使われていない40SサブユニットにHCVのIRESが結合して、HCVのタンパク質合成が開始される」モデルよりも、「細胞のmRNAを翻訳中のリボソームにHCVのIRESが結合し乗っ取る」場合の方が、より効率よく頻繁に起こると考えられた。加えて、HCVゲノムの翻訳に使われている40Sサブユニットを、次のラウンドの翻訳の際にもう一度使うといったシステムも存在し得ることが示された。
クライオ電子顕微鏡をはじめとした先端的な計測手法と、試験管内再構成という生化学的な手法の組み合わせは、日本の構造生物学研究の強みのひとつ。今回の研究は、HCVのIRESが、これまで想定されていなかった方法で反応中の翻訳装置リボソームを乗っ取っていることを示した点で画期的。「今回明らかになった機構は、HCVのIRESと同じような構造を持つウイルスに共通すると考えられるため、今後は効果的な抗ウイルス薬になる可能性がある」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



