免疫チェックポイント分子PD-1の第2リガンドPD-L2の機能を研究
東京医科歯科大学は4月16日、マウス接触過敏症モデルにおけるPD-L2 siRNA軟膏の皮膚塗布による遺伝子発現制御という手法を用いて、表皮ランゲルハンス細胞上に発現誘導されるPD-L2は免疫賦活に働いていることを見出したと発表した。この研究は、同大大学院医歯学総合研究科分子免疫学分野の東みゆき教授、皮膚科学分野の横関博雄教授、小児歯科学分野の宮新美智世准教授および古澤慧美大学院生らの研究グループが、株式会社メドレックスと共同で行ったもの。研究成果は、国際科学誌「Journal of Investigative Dermatology」のオンライン速報版で4月9日に発表された。
画像はリリースより
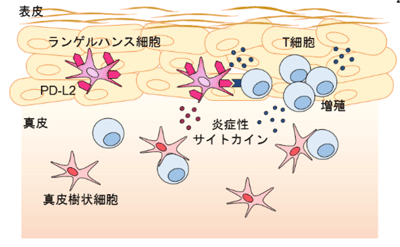
皮膚や粘膜の表層に存在する樹状細胞は、外来抗原を捕捉し自然免疫応答を起動させるとともに、その抗原情報をT細胞に伝えて獲得免疫応答を起動させる免疫システムの司令塔の役割を果たしている。皮膚最表層の表皮に存在する特殊な樹状細胞であるランゲルハンス細胞は、表皮細胞や真皮樹状細胞、メモリーT細胞との細胞間相互作用により局所免疫応答と寛容の維持に関わっている。
樹状細胞に発現誘導される共刺激分子は、T細胞の機能調節の鍵となる。CD86はT細胞応答を増強させるアクセル型共刺激分子で、T細胞上の活性化共刺激受容体CD28に結合。反対に、免疫チェックポイント分子として注目されているPD-1はブレーキをかける抑制性共刺激受容体。PD-1受容体のリガンドには、PD-L1とPD-L2の2つがあるが、PD-L1のPD-1受容体への結合が感染防御や自己免疫などのT細胞応答においてブレーキとして働くことが明確であるのに対し、PD-L2の機能は明らかにされていなかった。
PD-L2を標的とした皮膚局所塗布薬としてのsiRNA核酸医薬開発に期待
研究グループはこれまでに、マウスモデルでCD86 siRNA軟膏塗布が、皮膚樹状細胞に誘導されるCD86発現を抑制し、ハプテン誘導性接触過敏症およびダニ抗原によるアトピー性皮膚炎の症状を改善できることを報告していた。核酸医薬開発の課題の1つは標的細胞にいかに核酸を効率よく到達させるかだが、樹状細胞自身の監視機能と抗原捕捉能により、特段のデリバリー手段を必要とせずに遺伝子サイレンシングが可能だった。
今回研究グループは、皮膚樹状細胞におけるPD-L2の機能を解明するため、siRNA軟膏塗布による遺伝子発現制御の手法を用いて、マウス接触性皮膚炎とアトピー性皮膚炎モデルでPD-L2 siRNA局所塗布を行い、皮膚樹状細胞上に発現するPD-L2の機能を検討した。その結果、培養骨髄由来成熟樹状細胞および生体で活性化された樹状細胞上に、PD-L2は CD86と共発現していた。ハプテン抗原の皮膚塗布により、ランゲルハンス細胞上にPD-L2の発現誘導が認められ、惹起時のPD-L2 siRNA軟膏塗布で、PD-L2発現の抑制と皮膚炎の抑制が認められた。このPD-L2 siRNAによる抑制は、PD-1/PD-L1欠損マウスにおいても同様にみられることから、PD-1受容体に依存していないことが示された。また、この抑制には、皮膚に局在するT細胞が不可欠であることから、T細胞との相互作用が関わっていることが判明した。接触過敏モデルでのPD-L2 siRNA軟膏塗布による抑制効果は、CD86 siRNA軟膏とほぼ同様だったが、アトピー性皮膚炎モデルでは抑制効果を認めなかった。
これらの結果から、接触過敏応答ではランゲルハンス細胞に発現するPD-L2がT細胞依存性の皮膚炎症応答の増強に関与していることが示唆された。今後、接触性皮膚炎の治療に、CD86のみならずPD-L2を標的としたsiRNA核酸医薬開発への応用が期待される。
▼関連リンク
・外部リンク 東京医科歯科大学 プレス通知資料






