不明だった肥満でM2aマクロファージ活性が障害される原因
東京大学医学部附属病院は11月19日、肥満における慢性炎症の新規発症メカニズムを解明したと発表した。この研究は、東京大学大学院医学系研究科糖尿病・生活習慣病予防講座の門脇孝特任教授、同大医学部附属病院病態栄養治療部の窪田直人部長、理化学研究所生命医科学研究センター粘膜システム研究チームの窪田哲也上級研究員らの研究グループによるもの。研究成果は「Nature Communications」にて発表されている。
画像はリリースより
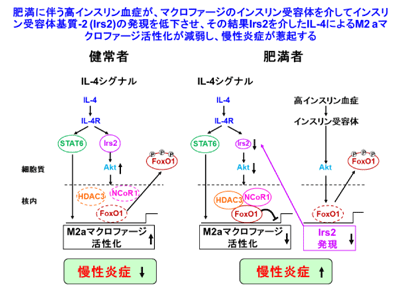
代謝異常を伴う肥満患者と代謝異常を伴わない肥満患者の比較から、肥満に伴う代謝異常の基盤病態として、慢性炎症の重要性が示唆されている。慢性炎症を制御するマクロファージは、大きく炎症性サイトカインを分泌するM1マクロファージと抗炎症性サイトカインを分泌するM2マクロファージに分類され、脂肪細胞の肥大化に伴うM1マクロファージの増加とM2マクロファージの減少が、慢性炎症の原因と考えられている。
これまで慢性炎症の分子機構については主に、M1マクロファージ活性化機構を中心に解析されてきたが、M2マクロファージ、特にその中でも中心的な役割を果たしているM2aマクロファージ活性が、肥満においてなぜ障害されるのか、その分子機構は全く不明だった。
Irs2の発現低下でIL-4を介したM2aマクロファージ活性化障害が惹起
研究グループは、マクロファージにおけるIrs2の役割を明らかにするため、ミエロイド特異的Irs2欠損(MIrs2KO)マウスを作製し、高脂肪食負荷を行い解析。その結果、肥満の程度や脂肪細胞のサイズに差はなかったが、インスリン抵抗性や耐糖能異常が認められ、F4/80陽性のマクロファージ集簇に伴うcrown-like structure(CLS)の有意な増加と炎症性サイトカインの上昇を呈した。特にM2aマクロファージ関連遺伝子の発現が著明に低下しており、Irs2がM2aマクロファージ活性化に重要な役割を果たしていることが明らかとなった。
次にIL-4-Irs2を介した遺伝子発現調節機構について、EMSA、Chip-qPCR、共免疫沈降法を用いて解析したところ、FoxO1/HDAC3/NCoR1がCorepressor Complexを形成していること、IL-4刺激が入るとIrs2/PI3K/Aktを介してFoxO1がリン酸化され、FoxO1/HDAC3/NCoR1 Corepressor Complexが解離し、M2aマクロファージが活性化されることが判明した。つまり、肥満では、IL-4によるSTAT6活性化は変化しないが、Irs2の発現が低下するためにIrs2を介するIL-4シグナルが減弱し、FoxO1/HDAC3/NCoR1 Corepressor Complexの乖離が十分に起こらないため、M2aマクロファージ活性が障害されていることが示唆されたという。
次にIrs2が肥満で低下するメカニズムを検討するために、インスリン受容体を介したインスリンシグナルに着目し、ミエロイド特異的インスリン受容体欠損(MIRKO)マウスを作製し解析を行った。このマウスではMIrs2KOマウスとは逆の表現型を呈し、インスリン感受性を示し炎症性サイトカインも低下し、M2aマクロファージ関連遺伝子の発現も有意に上昇していた。MIRKOマウスのマクロファージでは、Irs2の発現が有意に上昇しており、Irs2の発現低下は肥満に伴うインスリン受容体を介した高インスリン血症によるものであることが示唆された。実際に、細胞を用いた実験からコントロールマウスでは、インスリン添加によりIrs2の発現は低下しましたが、MIRKOマウスではこうした低下は認められなかった。これらの結果から、肥満・インスリン抵抗性に伴う高インスリン血症はインスリン受容体を介してIrs2の発現を低下させ、IL-4によるIrs2を介したM2aマクロファージの活性化が障害されることにより、慢性炎症や代謝異常が引き起こされていることが明らかとなった。
今回の研究で、食事療法や運動療法、既存の薬剤などによる高インスリン血症是正の重要性が改めて示されたとともに、マクロファージのIrs2の働きや、その下流のシグナルを活性化させるような薬剤が、肥満を解消せずとも糖尿病や脂質異常症等、肥満関連代謝疾患を改善できる新たな治療薬の開発につながることが期待される。
▼関連リンク
・東京大学医学部附属病院 プレスリリース






