神経変性疾患などを引き起こすマイトファジーの機能不全
順天堂大学は10月11日、オートファジーレセプターのひとつであるNDP52がミトコンドリア内に侵入し、ミトコンドリアRNA poly(A)ポリメラーゼ(MTPAP)と相互作用することで不良ミトコンドリア選択的なオートファジー(マイトファジー)を促進することを発見したと発表した。この研究は、同大大学院医学研究科・オートファジー調節化合物探索研究講座の古屋徳彦助教、神経学講座の服部信孝教授らの研究グループによるもの。研究成果は「EMBO Reports」に掲載されている。
画像はリリースより
マイトファジーは不良ミトコンドリアを選択的に分解するミトコンドリア品質管理機構で、不良ミトコンドリアをオートファゴソームで包みこみ、リソソームへと送り分解する。マイトファジーが働かなくなると、細胞内に不良ミトコンドリアが蓄積し、神経変性疾患などを引き起こすため、不良ミトコンドリアが関わる疾患群の病態との関わりや治療法開発の糸口として注目されている。
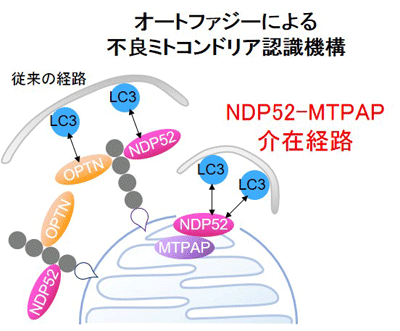
現在、ほ乳類の細胞において最もその分子機構が明らかにされているマイトファジーはPINK1/Parkin介在性マイトファジーだ。PINK1とParkinはともに家族性パーキンソン病の原因遺伝子から合成されるタンパク質で、協働して不良ミトコンドリアをマイトファジーに導く目印(ユビキチン鎖)を付加する働きがある。目印の付けられたミトコンドリアには、目印とオートファゴソーム膜の両方に結合するオートファジーレセプターが結合し、不良ミトコンドリアをマイトファジーへと導く。研究グループは、オートファジーレセプターのひとつであるNDP52が不良ミトコンドリアの一部のみに局在するという、他のオートファジーレセプターと異なる挙動をとることに着目。NDP52のマイトファジーにおける役割を解明する目的で研究を行った。
NDP52とMTPAPの結合を介した働きでマイトファジーが促進
今回の研究では、まず培養細胞を用い、PINK1/Parkin介在性マイトファジー誘導時におけるオートファジーレセプターの挙動をタイムラプス顕微鏡で観察。その結果、同じオートファジーレセプターであっても、OPTNは不良ミトコンドリア上にまんべんなく蓄積する挙動をとるのに対し、NDP52は一部のミトコンドリアに一定時間局在するという挙動をとることを見出した。
また、SKICHドメインを介してNDP52と結合するタンパク質を探索した結果、ミトコンドリアRNA poly(A)ポリメラーゼ(MTPAP)というタンパク質を同定した。MTPAPの発現を抑えた細胞においても、NDP52の挙動はOPTNと類似したものに変化することから、NDP52特有の挙動はSKICHドメインを介したMTPAPとの結合によるものと示唆された。
さらに、タンパク質分解酵素複合体であるプロテアソームにより、ミトコンドリア外膜に穴があくことで、NDP52がミトコンドリア内部に侵入することが判明。NDP52とMTPAPが結合した複合体は、NDP52単独よりオートファゴソーム膜上に存在するタンパク質LC3との親和性が高く、NDP52-MTPAP複合体が形成されたミトコンドリアはよりマイトファジーを受けやすいことがわかった。これらの結果から、NDP52は、従来から報告のあったユビキチン鎖とLC3との結合を介したオートファジーレセプターとしての働きに加え、MTPAPとの結合を介した働きによりマイトファジーを促進していることが明らかとなったとしている。
今回の研究結果は、細胞が不良ミトコンドリアを取り除く新しいメカニズムを見出しただけでなく、細胞質のタンパク質がミトコンドリアに侵入し、ミトコンドリア内部のタンパク質と相互作用するという機構が存在することを示した世界初の知見であり、細胞生物学的に非常に重要だ。また、不良ミトコンドリア蓄積を原因とするパーキンソン病などの神経変性疾患の予防・治療につながるものと期待されることから、研究グループは「さらにマイトファジーの分子機構に対する研究を進めて、これらの疾患の原因究明、予防・治療法開発に繋げていきたい考えている」と述べている。
▼関連リンク
・順天堂大学 プレスリリース






