心不全や認知症につながるタウファミリータンパク質の破綻
神戸大学は10月2日、体中のあらゆる細胞の形を制御する微小管結合タンパク質の1つ「MAP4」の詳細な構造を明らかにすることに成功したと発表した。この研究は、同大大学院医学研究科の仁田亮教授、今崎剛特命助教らの研究グループが、理化学研究所生命機能科学研究センターの白水美香子チームリーダー、同放射光科学研究センターの重松秀樹研究員、室蘭工業大学の徳楽清孝准教授らと共同で行ったもの。研究成果は、国際学術雑誌「The Journal of Cell Biology」にオンライン掲載されている。
画像はリリースより
MAP4はタウファミリータンパク質の1つで、細胞骨格を構成する微小管や分子モーターであるキネシンと複合体を形成する。タウファミリータンパク質を含む複合体の形成が破綻すると、心不全や認知症などさまざまな病態が引き起こされる。しかし、分子構造が柔軟に動くために、高分解能で立体構造を解明した報告はこれまでなかった。
神経変性疾患の病態解明や創薬につながる可能性
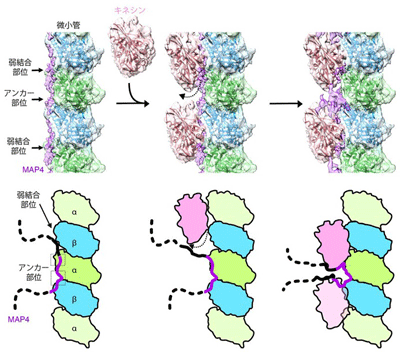
今回研究グループは、試験管内で微小管、MAP4、キネシンの三者複合体を再構成し、クライオ電子顕微鏡を用いて、その三者複合体の精細な立体構造を7オングストローム分解能で解析した。その結果、MAP4は微小管(αチュブリン、βチュブリン)の長軸に沿って結合して微小管を安定化していた。
MAP4と微小管との結合部位は、両者が強く結合する「アンカー部位」と弱く結合する「弱結合部位」の2種類が存在している。一方、分子モーターであるキネシンは、その弱結合部位にあるMAP4と微小管の結合に対して競合阻害の関係にある。そのため、キネシンが十分量存在すると、キネシンが弱結合部位のMAP4を追い出し、微小管と結合。その結果、MAP4と微小管はアンカー部位で結合しつつ、同時にキネシンが弱結合部位で微小管と結合していることが判明した。
さらに詳細に観察すると、MAP4は、微小管とアンカー部位で直接結合するだけでなく、微小管の上方で、キネシンとキネシンの間で折れ重なりコンパクトな構造となることにより、この部分がキネシンと相互作用をしてキネシンをつなぎ留め、キネシンの微小管上の動きを阻害していることが明らかになったという。
今回の研究成果は、生体内でのMAP4が過度に増加することより発症する心不全・心肥大などの新たな治療戦略を立案する上で重要な示唆を与えるもの。また、MAP4と非常によく似たアミノ酸配列を持つタウも同様の立体構造をとる可能性が高く、認知症などを含めた神経変性疾患の病態解明にもつながる成果であるという。今後は、さらに分解能を向上させて精細な分子構造を観察し、またMAP4および微小管の細胞内の微細形態を解明することによって、心不全や認知症をはじめとする細胞の変形を伴う疾患の細胞レベルの病態解明や創薬への応用につながることが期待される、と研究グループは述べている。
▼関連リンク
・神戸大学 研究ニュース



