筋萎縮性側索硬化症におけるミトコンドリア断片化、σ1受容体の機能喪失との関係は未解明
名古屋大学は2月15日、筋萎縮性側索硬化症(ALS)においてσ1受容体がミトコンドリア形態を制御するメカニズムを新たに発見したと発表した。この研究は、同大環境医学研究所の山中宏二教授、渡邊征爾助教、堀内麻衣大学院生らの研究グループによるもの。研究成果は、「Neurobiology of Disease」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
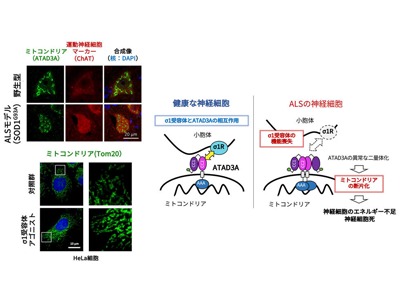
筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS)は、運動神経細胞が選択的に傷害され、全身が進行性に麻痺していく難病である。ALSのほとんどは遺伝的背景をもたない孤発性だが、一部に遺伝性に発症するALSも存在し、その原因遺伝子をもとに神経細胞死のメカニズム解明や治療法開発の研究が行われている。σ1受容体もALS原因遺伝子のひとつであり、研究グループは以前、σ1受容体の機能喪失がミトコンドリアと小胞体の機能異常を引き起こすメカニズムの一部を明らかにしていた。ミトコンドリアは神経細胞のエネルギー供給源として極めて重要なオルガネラ(細胞内小器官)で、ALSでも以前からミトコンドリアの断片化、および断片化に伴うエネルギー産生機能の低下が神経細胞死の要因となると報告されている。しかし、ALSにおいて、どのような仕組みでミトコンドリアの断片化が生じるかは明らかになっていなかった。
ALSモデルマウスでATAD3Aタンパク質の異常化によるミトコンドリアの断片化を確認
そこで研究グループは、ATAD3Aと呼ばれるタンパク質に着目した。ATAD3Aはミトコンドリアの膜上に存在するタンパク質で、近年、アルツハイマー病やハンチントン病で異常化してミトコンドリアの断片化を引き起こすことが知られている。研究グループは、このATAD3AがALSにおいてもミトコンドリアの断片化に寄与するのではないかと考え、その検証を行った。結果として、ALSモデルマウスの脊髄運動神経細胞では、ミトコンドリアがATAD3Aの異常化を伴って断片化していることを発見した。
σ1受容体はATAD3Aの二量体化を抑制することで、ミトコンドリアの断片化を抑制
ALSではσ1受容体の機能が失われていることから、σ1受容体を欠損したマウスでも検証したところ、やはり同様にATAD3Aの異常化を伴ったミトコンドリアの断片化が観察された。このことから、σ1受容体の機能がATAD3Aの異常化に関与することが示唆された。詳しく調べると、ATAD3Aは同じ分子が2つ結合した二量体でミトコンドリアの断片化を誘導するが、σ1受容体はATAD3Aの二量体化を抑制して単量体状態にATAD3Aを保つことでミトコンドリアの断片化、ひいては機能低下を抑制していることが明らかになった。
実際に培養細胞においてσ1受容体をアゴニスト(受容体を活性化する化合物)で活性化させると、単量体のATAD3Aが増加し、それに伴ってミトコンドリアの伸長が誘導されることを確認した。以上の結果は、σ1受容体がATAD3Aと相互作用することでミトコンドリアの断片化を抑制して機能を保っているところ、ALSではσ1受容体の機能が失われるためにATAD3Aの異常な二量体化が亢進してミトコンドリアの断片化と機能低下が引き起こされることが判明した。
アルツハイマー病やハンチントン病など、他の神経変性疾患の治療法開発にもつながると期待
今回の研究では、σ1受容体がATAD3Aとの相互作用を介してミトコンドリアの形態と機能を維持していることを初めて明らかにした。「ATAD3Aの異常化はアルツハイマー病やハンチントン病など、他の神経変性疾患でも知られており、σ1受容体とATAD3Aの相互作用を促進することで、今後ALSを含めた神経変性疾患の新たな治療法開発につながると期待される」と、研究グループは述べている。
▼関連リンク
・名古屋大学 研究成果発信サイト



