ADCによるがん治療、標的抗原の不均一発現による薬剤効果の限定が課題
名古屋大学は8月22日、がんの不均一性を克服しうる新技術として、がん局所に抗体薬剤複合体(ADC)を集積させ、光でがんを破壊すると同時に抗がん薬を周囲に放出する光応答性”スマート武装抗体(Smart ADC)”を開発し、その新しい効果を光バイスタンダー効果(Photo-bystandar effect)と名付けたと発表した。この研究は、同大大学院医学系研究科・病態内科学講座呼吸器内科の高橋一臣大学院生(現、中部ろうさい病院呼吸器内科)、佐藤和秀特任講師(同大高等研究院 B3 ユニットフロンティア長)、同大未来社会想像機構ナノライフシステム研究所・量子科学技術研究開発機構(QST)量子生命科学研究所の馬場嘉信教授・所長、湯川博特任教授・QSTプロジェクトディレクター、米国の国立衛生研究所・国立がん研究所の小林久隆主席研究員らの研究グループによるもの。研究成果は、「Bioengineering & Translational Medicine」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
近年、がんの治療には抗体と薬物・光吸収体・核種などを付加した抗体薬物複合体が広く使用されるようになってきており、新しいがん治療薬の分野として注目されている。がん標的抗原に対しての抗体を用いることで、がん部位のみを治療することができ副作用を抑えることができる利点があり、とくに抗体と抗がん剤をリンカーにより結びつけたADCは国産の薬剤が製薬企業により開発され実装されるなど、臨床腫瘍学において注目されている。
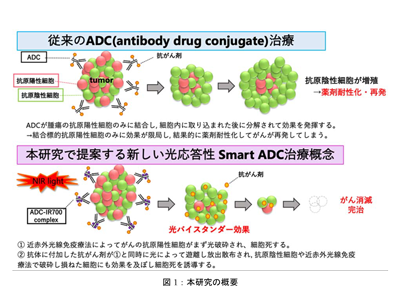
近赤外光線免疫療法(Near Infrared Photoimmunotherapy;NIR-PIT)は、同研究グループによって2011年に開発された新しいがん治療法であり、がん細胞が発現するタンパク質を特異的に認識する抗体と光感受性物質IR700の複合体を合成し、細胞表面の標的タンパク質に結合させた状態で690nm付近の近赤外光を照射すると、がん細胞が破壊される。これらの細胞死機序は、光化学反応をもとにした新概念の細胞死であることがすでに明らかにされている。これまでと異なる方法でがん細胞を標的破壊できることから、手術・放射線・化学療法・がん免疫療法につづく、「第5のがん治療」として期待されており、世界に先駆けて日本で2020年9月にEGFRを高発現する再発既治療頭頸部がんに対して、早期限定承認を受けて保険適用されている。NIR-PITも抗体に光吸収体を付加しており、広い意味でADCを用いた治療といえる。しかしながら、固形がん表面の標的抗原に対しての抗体治療には、その高い標的性によって固形がんの不均一性の一つである標的抗原の不均一発現により効果が限定されてしまうという臨床上の課題がある。これまでこの不均一性を克服するためにさまざまな研究が行われているが、現状うまくいっておらず、がんの再発や治療効果の限定につながっている。
光照射で抗原陽性細胞が破壊されるとともに薬剤が放出され、破壊し損ねたがん細胞も破壊
今回の研究では、ADCを簡便な方法によってがん局所に集積させた後で薬剤のみを光放出することに成功し、また、その光照射による近赤外光線免疫療法の効果を同時に発揮することで、2段構えでがんを制圧できる、上記のがんの標的抗原発現の不均一性を克服する新概念を創出することに成功した。研究グループは、この新しい技術を光応答性“スマート武装抗体”、そのユニークな効果を光バイスタンダー効果と名付けた。
まず、がん特異抗原であるHER2に対しての認可済みの抗体医薬であるトラスツズマブ(Tra)と、Traに抗がん剤(DM1)を付加した抗体薬物複合体(ADC)であるトラスツズマブエムタンシン(T-DM1)にIR700を付加して、Tra-IR700とT-DM1-IR700を作成した。T-DM1は構造的に生体内では結合したがん細胞内に取り込まれた後でしかDM1を放出しない、非開裂の安定なチオール結合のSMCCリンカーで抗体とDM1が結合している。静脈注射後に安定してがん部位に届き集積したのちに、がん細胞表面のHER2受容体に結合してがん細胞内に取り込まれて効果を発揮する。T-DM1-IR700を近赤外光照射して、質量分析を行うと、照射しない場合は何も検出できなかったが、16(J/cm2)の光照射ではDM1の誘導体が検出され、T-DM1-IR700から光照射によりDM1誘導体が放出されること(光による薬剤放出機能)を証明した。この機構は抗体を変えても同様に放出されることから、さまざまながんの特異標的に対する抗体にも利用できると判明した。
がんの不均一性モデルでも、臓器横断的に抗がん効果を確認
次に、がんの不均一性をモデルとするためにHER2を高発現するマウスがん細胞である3T3/HER2とHER2を発現しないヒト乳がん細胞であるMDAMB468細胞を混ぜたがん標的抗原不均一発現モデルを構築した。In vitroとマウス腫瘍モデルで、T-DM1-IR700と近赤外光線の組み合わせで、薬剤が結合していないMDAMB468細胞への抗がん効果が確認できた。動物モデルでは生存期間の延長がみられ、光バイスタンダー効果が動物モデルでも確認できた。また、治療した動物モデルではがんが完治したものが存在し、がんの根治を目指せる治療法であることが示唆されたという。さらには、肺がん細胞を用いた実験でも上記と同じ結果が得られ、臓器横断的にこの治療概念が応用できると考えられた。
上記の結果から、静脈投与により腫瘍に薬剤を集積させた後に、腫瘍部位に近赤外光線を照射することで、近赤外光線免疫療法の効果により抗体で標的するがん細胞を破砕し、それと同時に光照射によって近傍へ放出される抗がん剤の作用によって、標的から漏れたがん細胞を光バイスタンダー効果で細胞死に至らしめる2段構えの抗がん効果によって、がんの不均一な発現からくる治療抵抗性を克服できる新しい治療概念を創出することに成功した。
がん不均一性を克服する新しい新技術として、幅広いがん治療に期待
今回の研究成果では、ADCを簡便な方法によってがん局所に集積後に薬剤を光放出することに成功し、また、その光照射による近赤外光線免疫療法の効果を同時に発揮する2段構えの抗がん効果によって、臨床上での課題であるがんの標的抗原発現の不均一性を克服する新概念を創出することに成功した。がん不均一性を克服する新しい新技術としてがん根絶へとつながることを期待している。さらに、研究で使用したADCはすでにがん治療に認可されて日常的に抗がん治療薬剤として使用されており、また近赤外光線免疫療法も限定承認を受けていることから、この治療方法は臨床応用が容易と考えられる。加えて、抗体を変えることで、あらゆる種類のがんへの応用を可能とすることから、幅広くがん治療に貢献できると期待される。「本治療は、がん特異標的抗原の不均一な発現で再発が問題となっている固形がんへの抗体治療の概念を一歩進めるものとして、また、実装されて間もない近赤外光線免疫療法の効果を高める新しい方法として臨床現場で将来的に使用できると期待される」と、研究グループは述べている。
▼関連リンク
・名古屋大学 プレスリリース



